-
Figura 1-1. Prevalencia de hipertensión en adultos mexicanos (> 20 años).
-
Figura 7-1. Rutas de señalización para la secreción de GLP-1 en las células L intestinales.
-
Figura 7-5. Inhibidores de la dipeptidilpeptidasa-4 en uso clínico.
-
Figura 7-9. Glitazonas agonistas del receptor activado para proliferación de peroxisomas (PPAR?).
-
Figura 7-11. Mecanismo de la reacción de desfosforilación catalizada por la PTP1B.
-
Figura 7-14. Estructura de la glucocinasa (GC) humana unida a glucosa y a un activador sintético.
-
Figura 7-20. Agonistas del FFAR1 descontinuados de los estudios clínicos.
-
Figura 7-22. Agonistas del GPR119 descontinuados de los estudios clínicos.
-
Figura 9-8_a. Compuestos fenólicos con actividad antidiabética.
-
Figura 9-8_b. Compuestos fenólicos con actividad antidiabética.
-
Figura 10-2. Similitudes y diferencias estructurales entre liraglutida y taspoglutida.
-
Figura 10-3. Similitudes y diferencias estructurales de semaglutida y albiglutida.
-
Figura 10-5. Antagonistas no peptídicos del glucagón humano.
-
Figura 10-6. Inhibidores ?-amino amídicos de la dipeptidilpeptidasa 4.
-
Figura 10-7. Inhibidores ?-amino amídicos de la dipeptidilpeptidasa 4.
-
Figura 10-8. Inhibidores xantínicos de la dipeptidilpeptidasa 4.
-
Figura 10-9. Inhibidores xantínicos de la dipeptidilpeptidasa 4.
-
Figura 10-10. Inhibidor pirazolpirrolidínico de la dipeptidilpeptidasa 4.
-
Figura 10-11. Inhibidores O-glucosídicos del cotransportador SGLT2.
-
Figura 10-12. Inhibidores C-arilglucosídicos del cotransportador SGLT2.
-
Figura 10-13. Agonistas potentes del receptor activado para proliferación de peroxisomas (PPAR?).
-
Figura 10-15. Agonistas parciales y moduladores selectivos de PPAR?.
-
Figura 10-17. Inhibidor de la proteína-tirosina fosfatasa 1B.
-
Figura 10-21. Agonistas del receptor 119 acoplado a proteína G.
-
Figura 11-4_a. Genes posibles para valorar su relación con la nefropatía diabética.
-
Figura 11-4_b. Genes posibles para valorar su relación con la nefropatía diabética.
-
Figura 11-4_c. Genes posibles para valorar su relación con la nefropatía diabética.
-
Figura 13-2. Morfología de los adipocitos blanco (izquierda) y pardo (derecha).
-
Figura 13-3. Localización del tejido adiposo pardo en el adulto.
-
Figura 15-1. Prevalencia de obesidad infantil (5 a 11 años). (Datos tomados de ENSANUT 2012.)2012).
-
Figura 16-6. Representación de la derivación biliopancreática.
-
Figura 17-3. Compuestos fenólicos con actividad antiobesidad.
-
Figura 18-1. Fármacos utilizados para el tratamiento de la obesidad en desuso.
-
Figura 18-2. Fármacos empleados para el tratamiento de la obesidad en uso.
-
Figura 18-3. Fármacos utilizados en combinación para el tratamiento de la obesidad en uso.
-
Figura 18-4. Fármacos en desarrollo con potencial uso para el tratamiento de la obesidad.
-
Figura 18-5. Fármacos con probable uso para el tratamiento de la obesidad en estudios clínicos.
![]() Capítulo 01. Epidemiología de las enfermedades crónicas no transmisibles en México.
Capítulo 01. Epidemiología de las enfermedades crónicas no transmisibles en México.
![]() Capítulo 07. Bases moleculares y farmacológicas de los tratamientos de la diabetes mellitus tipo 2.
Capítulo 07. Bases moleculares y farmacológicas de los tratamientos de la diabetes mellitus tipo 2.
![]() Capítulo 09. Fármacos antidiabéticos de origen natural.
Capítulo 09. Fármacos antidiabéticos de origen natural.
![]() Capítulo 10. Diseño y desarrollo de nuevos fármacos antidiabéticos.
Capítulo 10. Diseño y desarrollo de nuevos fármacos antidiabéticos.
![]() Capítulo 11. Medicina genómica y tratamiento génico-celular para la diabetes.
Capítulo 11. Medicina genómica y tratamiento génico-celular para la diabetes.
![]() Capítulo 13. El adipocito como célula endocrina.
Capítulo 13. El adipocito como célula endocrina.
![]() Capítulo 15. Obesidad infantil.
Capítulo 15. Obesidad infantil.
![]() Capítulo 16. Alternativas terapéuticas quirúrgicas para la obesidad.
Capítulo 16. Alternativas terapéuticas quirúrgicas para la obesidad.
![]() Capítulo 17. Alternativas de origen natural para el tratamiento de la obesidad.
Capítulo 17. Alternativas de origen natural para el tratamiento de la obesidad.
![]() Capítulo 18. Fármacos para el tratamiento de la obesidad: pasado, presente y futuro.
Capítulo 18. Fármacos para el tratamiento de la obesidad: pasado, presente y futuro.
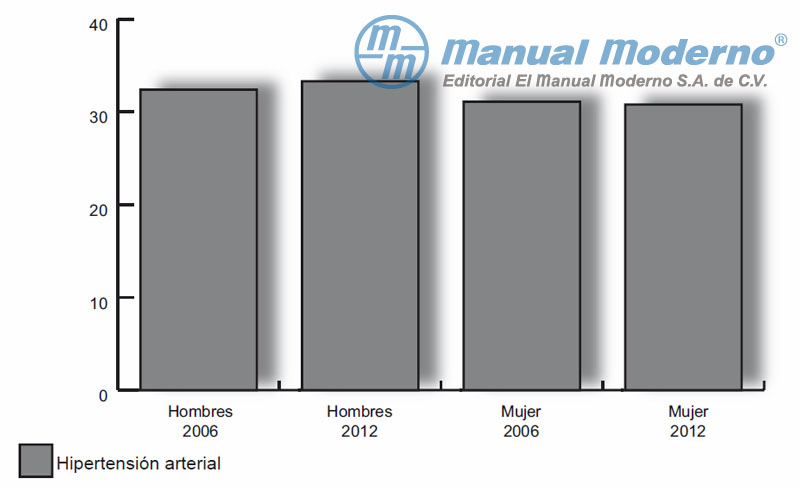
Figura 1-1. Prevalencia de hipertensión en adultos mexicanos (> 20 años).
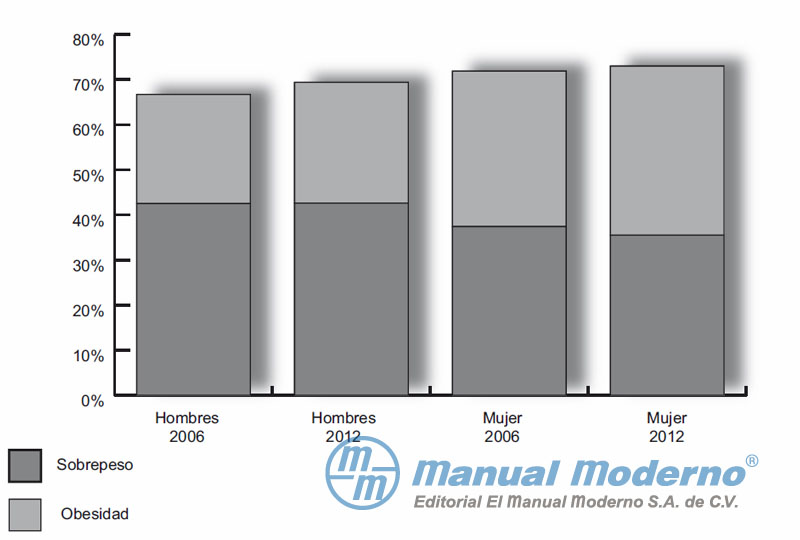
Figura 1-2. Prevalencia de obesidad en adultos (> 20 años).
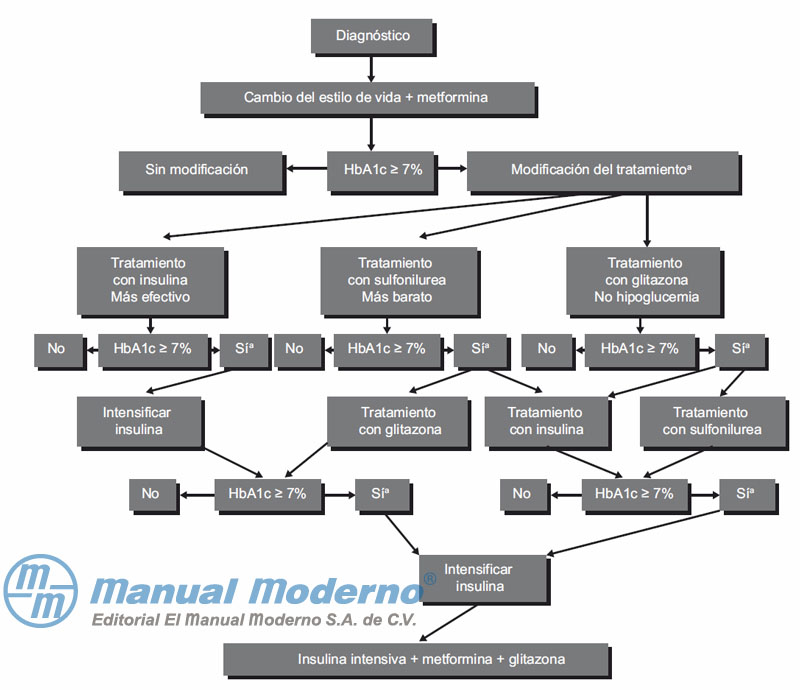
Figura 4-1. Control de la glucemia en la diabetes tipo 2.12 a Cuantificar hemoglobina glucosilada cada tres meses hasta que el valor sea <= 7 % y entonces al menos cada 6 meses. HbA1c = hemoglobina glucosilada.
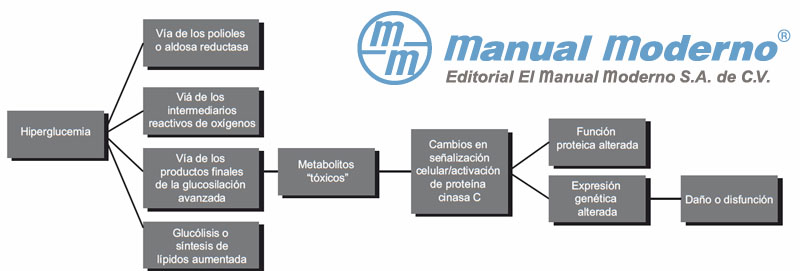
Figura 5-1. Mecanismos bioquímicos que intervienen en el desarrollo de las complicaciones de la diabetes.10-12
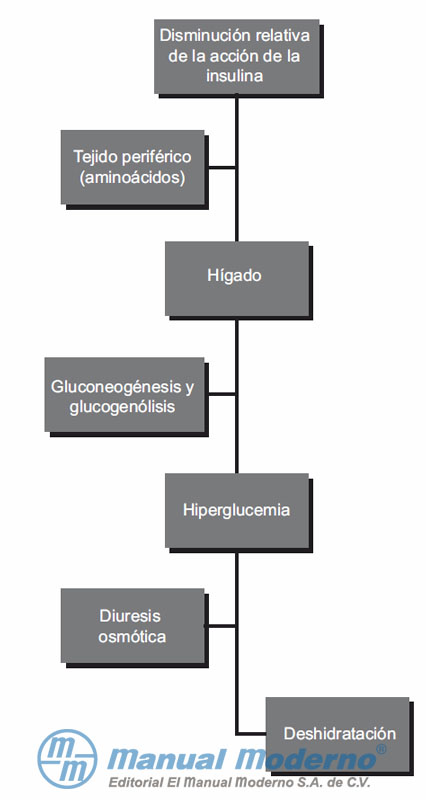
Figura 5-2. Mecanismos a través de los cuales se genera el estado hiperosmolar hiperglucémico en un paciente diabético.13,16
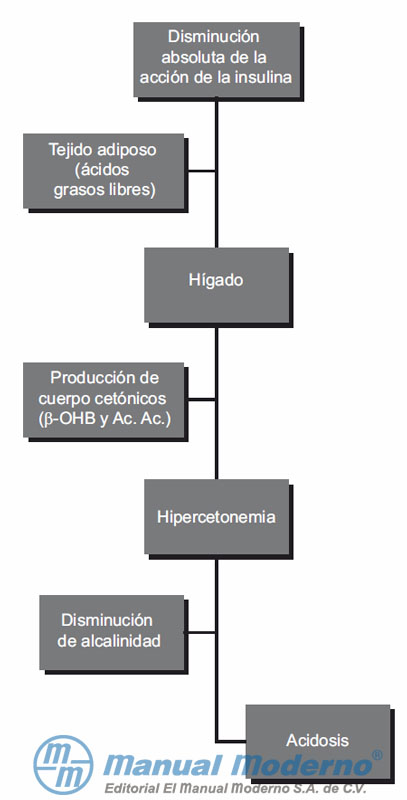
Figura 5-3. Mecanismos a través de los cuales se genera la cetoacidosis diabética en un paciente.13,16 ?-OHB, ácido hidroxibutírico ?; Ac. Ac., ácido acetoacético.
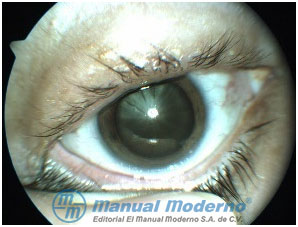
Figura 5-4. Catarata en el paciente diabético. (Cortesía del Dr. René Cervantes Castañeda, Codet Vision Institute).
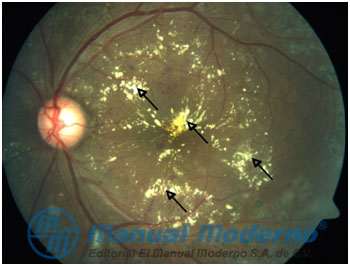
Figura 5-5. Edema macular diabético. Se pueden identificar exudados indurados señalados con flechas. (Cortesía del Dr. René Cervantes Castañeda, Codet Vision Institute).
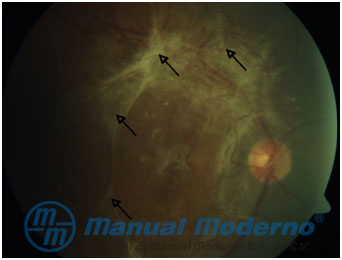
Figura 5-6. Retinopatía diabética proliferativa; membranas fibrovasculares vitreorretinianas señaladas con flechas. (Cortesía del Dr. René Cervantes Castañeda, Codet Vision Institute).
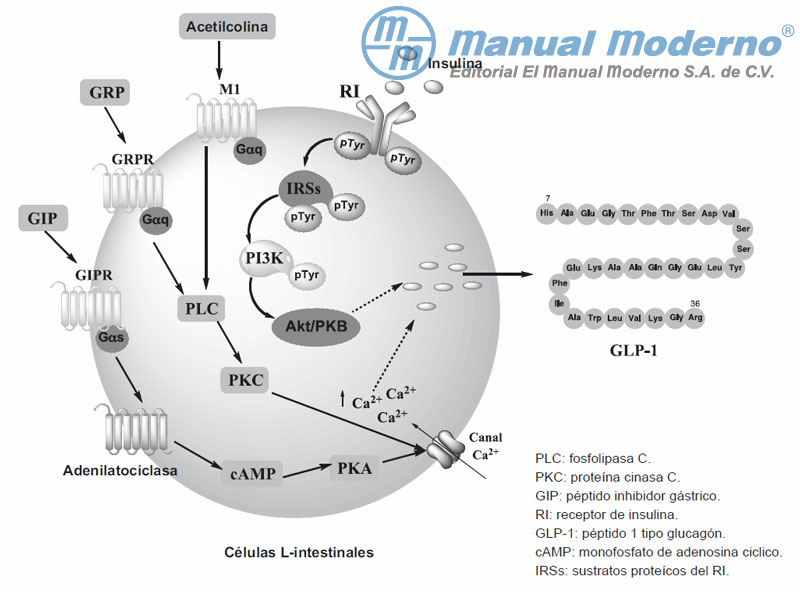
Figura 7-1. Rutas de señalización para la secreción de GLP-1 en las células L intestinales.
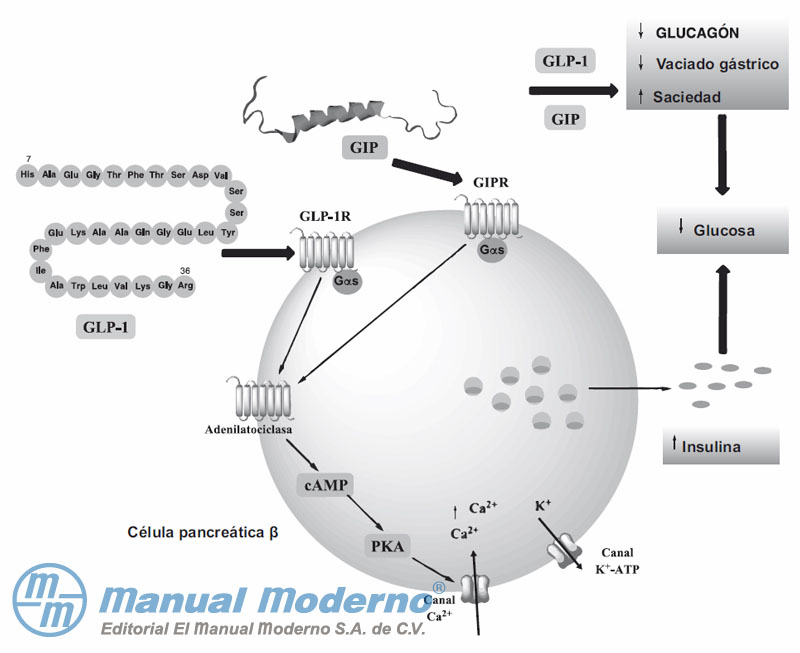
Figura 7-2. Secreción de insulina estimulada por acción del GLP-1 y del GIP en las células ? del páncreas.
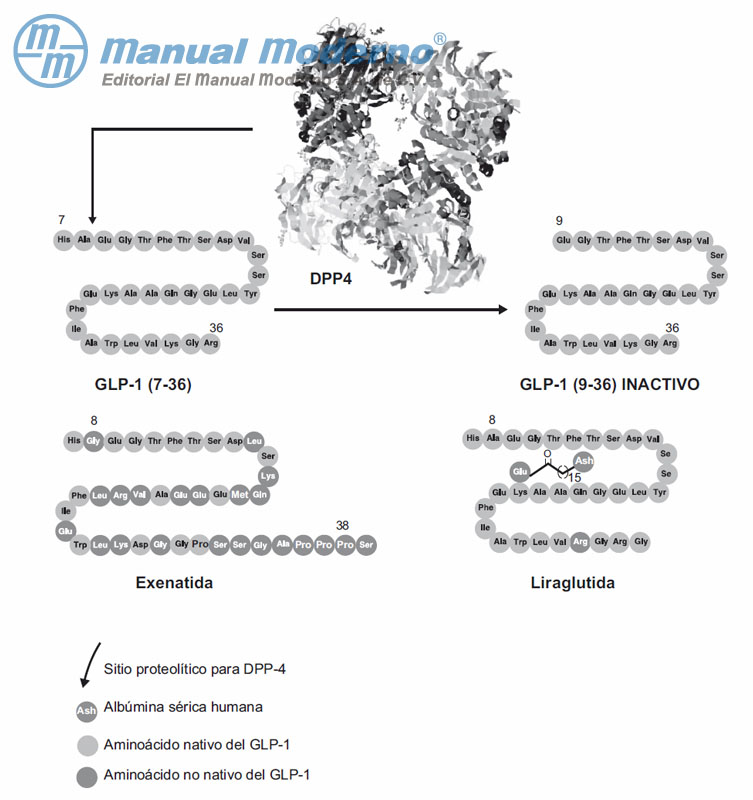
Figura 7-3. Inactivación del péptido-1 tipo glucagón (GLP-1) por acción de la dipeptidilpeptidasa-4 (DPP-4). Similitudes y diferencias estructurales entre el GLP-1, la exenatida y liraglutida.
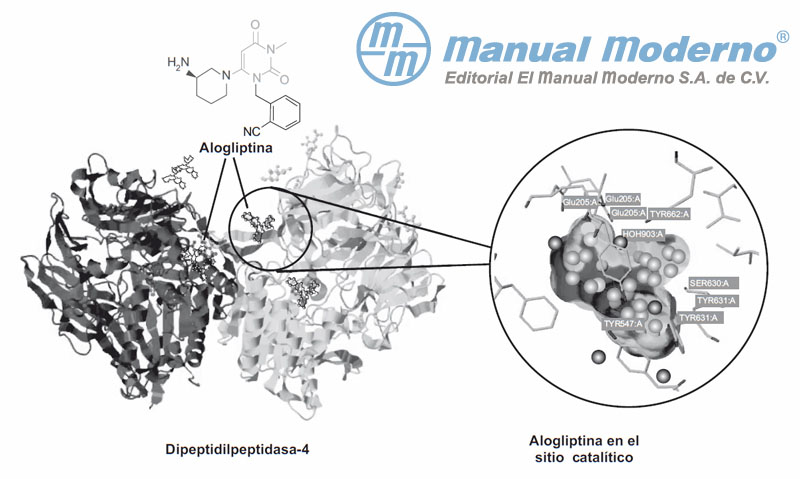
Figura 7-4. Estructura del complejo dipeptidilpeptidasa-4 (DPP-4)/Alogliptina. En la ampliación se observan los residuos del sitio catalítico que interaccionan con el inhibidor Alogliptina.
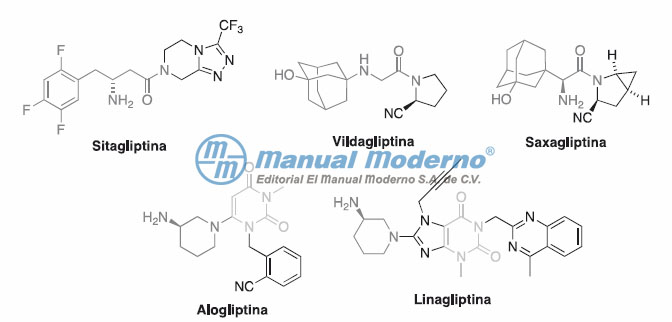
Figura 7-5. Inhibidores de la dipeptidilpeptidasa-4 en uso clínico.
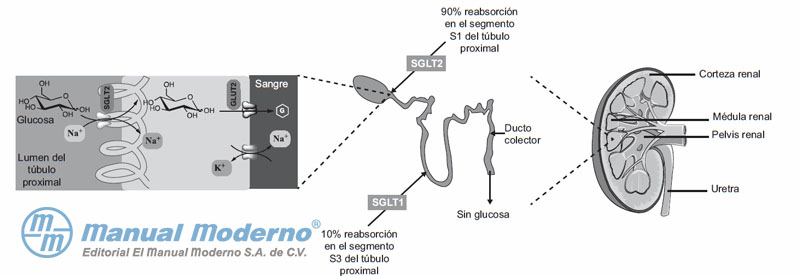
Figura 7-6. Reabsorción de la glucosa plasmática filtrada a través del túbulo proximal renal por los cotransportadores 1 y 2 de glucosa-sodio (SGLT1 y SGLT2).
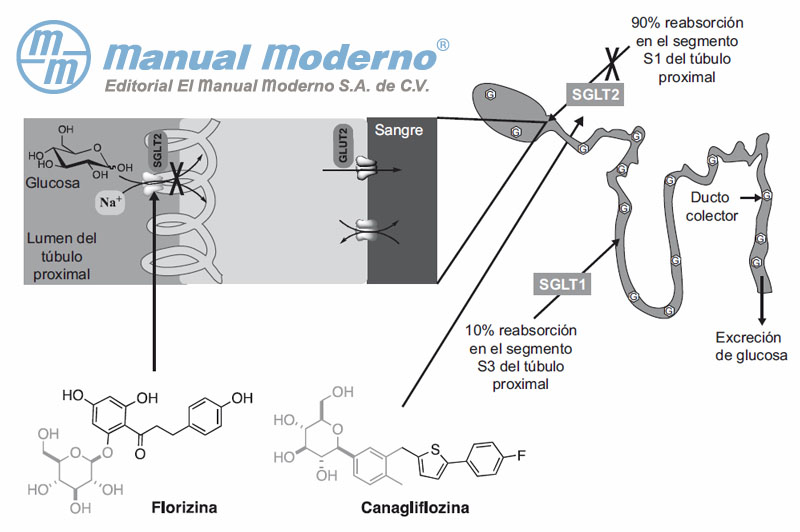
Figura 7-7. Inhibición del cotransportador-2 de glucosa/sodio (SGLT2) por los compuestos arilglucosídicos florizina y canaglifozina.
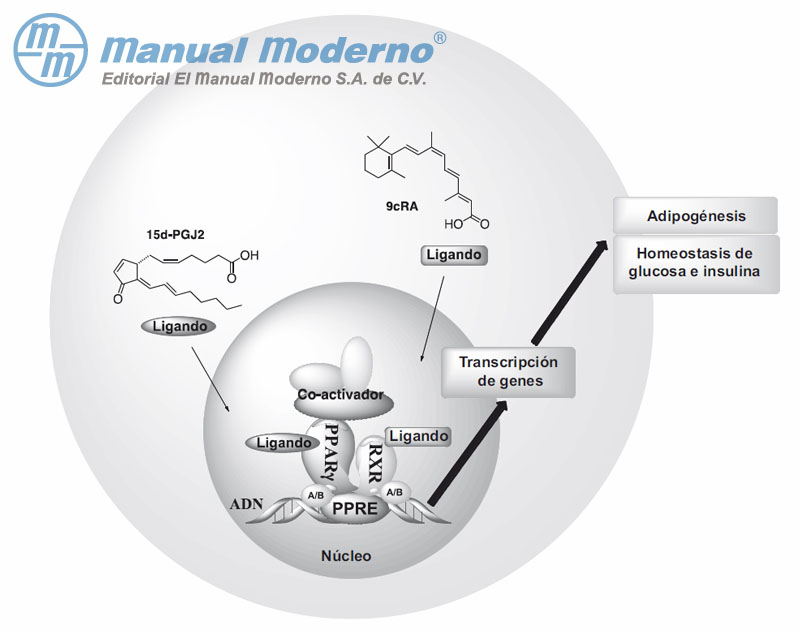
Figura 7-8. Heterodimerización del receptor ? activado para proliferación de peroxisoma (PPAR?) con el receptor X retinoide y unión al elemento de respuesta al PPAR del ADN (PPRE) para formar un complejo que será activado por ligandos y coactivadores para la transcripción de genes involucrados en la regulación del metabolismo de glucosa e insulina y en la adipogénesis.
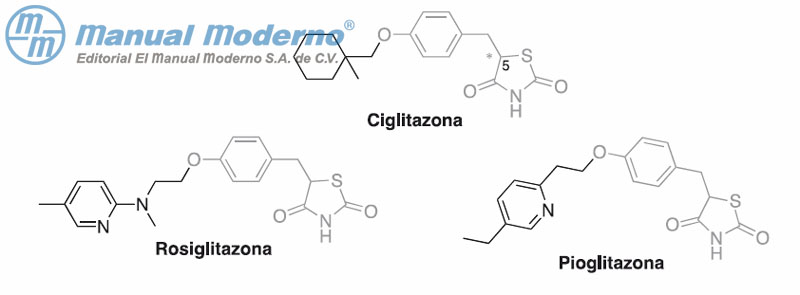
Figura 7-9. Glitazonas agonistas del receptor activado para proliferación de peroxisomas (PPAR?).
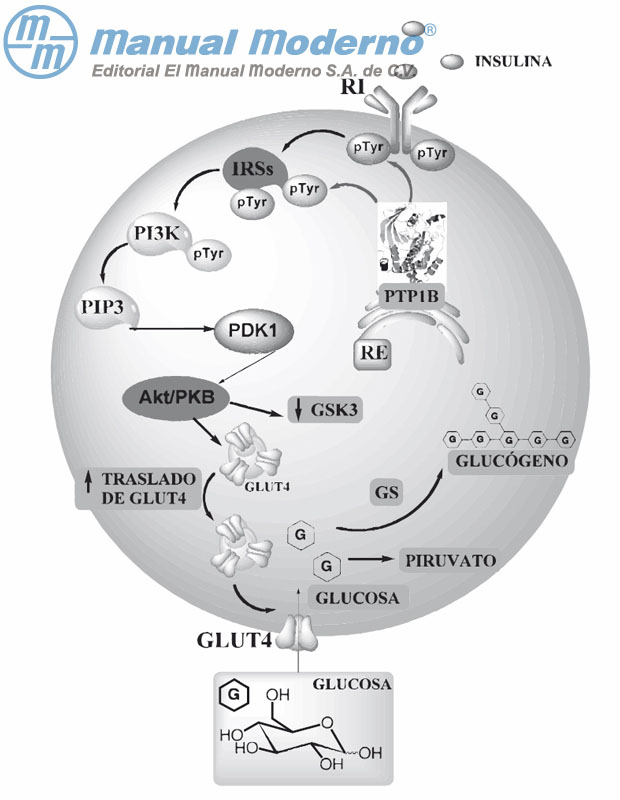
Figura 7-10. La cascada de señalización de la insulina promueve el traslado de GLUT4 a la superfi cie celular y la inactivación de la GSK3, favoreciéndose la glucogénesis y la glucólisis. Por lo contrario, la proteína-tirosina fosfatasa 1B modula negativamente la cascada de señalización de la insulina, disminuyéndose ambas rutas metabólicas.
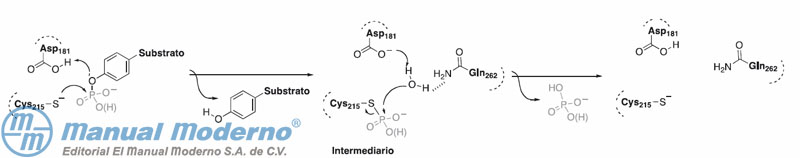
Figura 7-11. Mecanismo de la reacción de desfosforilación catalizada por la PTP1B.
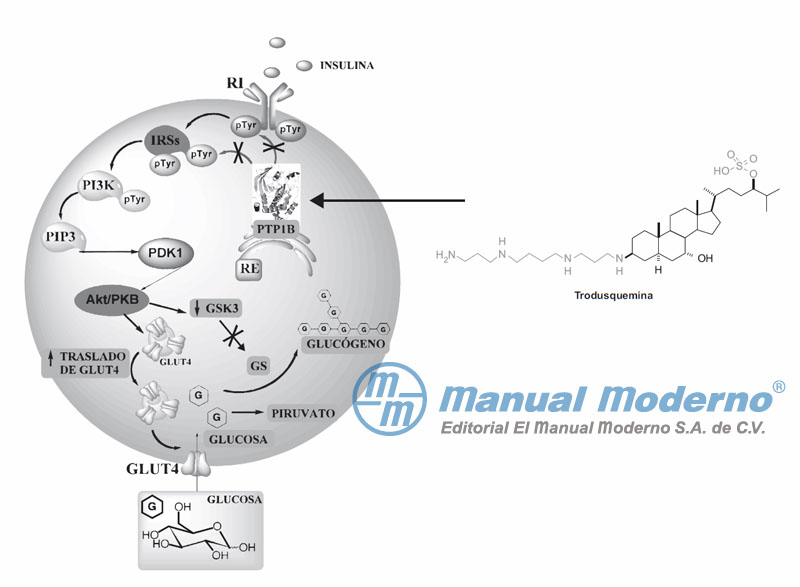
Figura 7-12. Inhibición de la proteína-tirosina fosfatasa 1B, por la trodusquemina, para aumentar la actividad de la GLUT4 y de la GS.
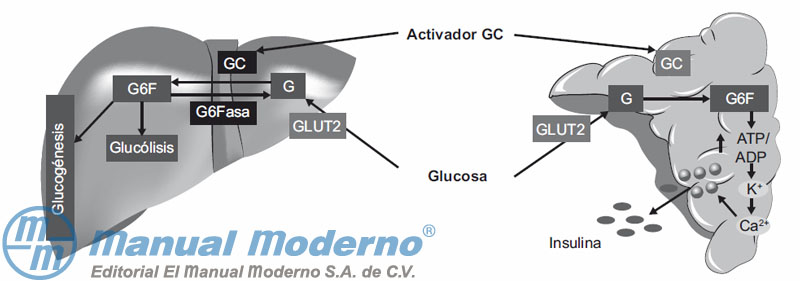
Figura 7-13. La activación de la glucocinasa (GC) promueve la conversión de glucosa (G) en glucosa-6-fosfato (G6F) para que ésta entre en la vía de la glucogénesis o la glucólisis en el hígado; en cambio, en el páncreas promueve un incremento de la concentración intracelular de Ca2+ para favorecer la secreción de insulina.
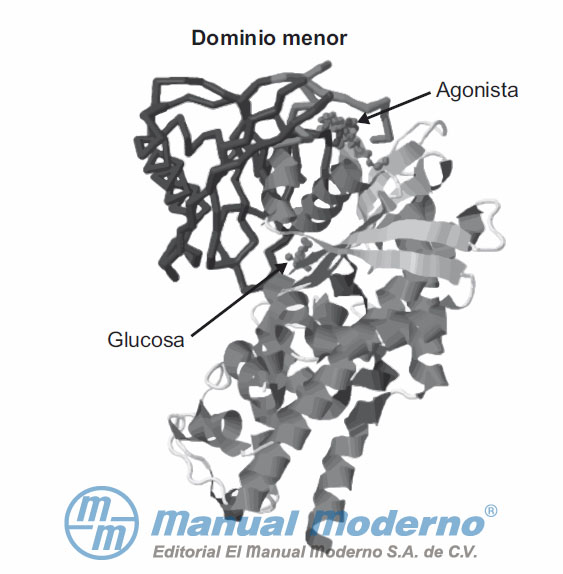
Figura 7-14. Estructura de la glucocinasa (GC) humana unida a glucosa y a un activador sintético.
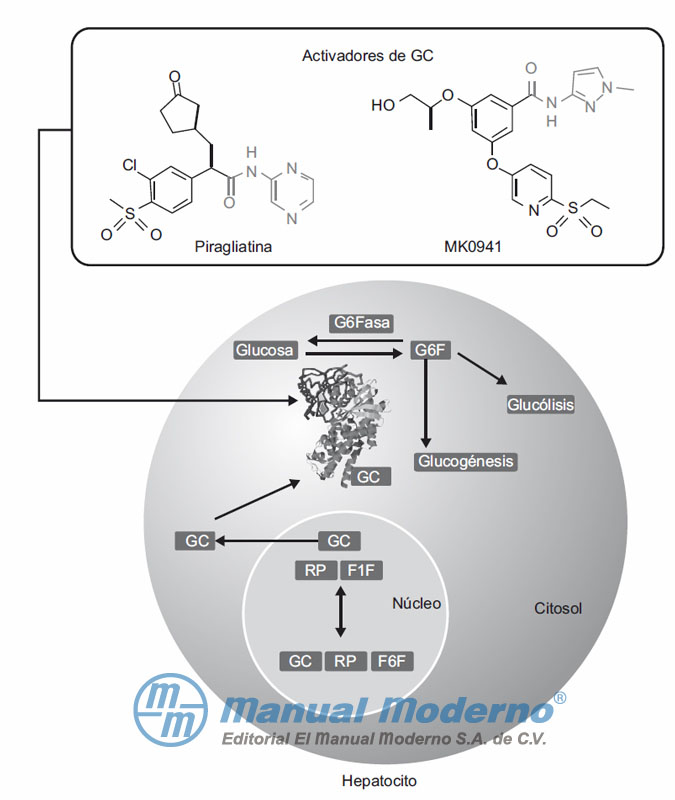
Figura 7-15. La glucocinasa (GC) unida a la proteína reguladora de GC (RP) y a la fructosa-6-fosfato (F6F) permanece inactiva en el núcleo. Cuando las concentraciones de glucosa aumentan, la GC se disocia del complejo GC/RP/F6F en presencia de fructosa-1-fosfato (F1F) para trasladarse al citosol y favorecer la glucólisis y la glucogénesis. Los activadores de GC, piragliatina y MK0941, incrementan la actividad catalítica de la GC.
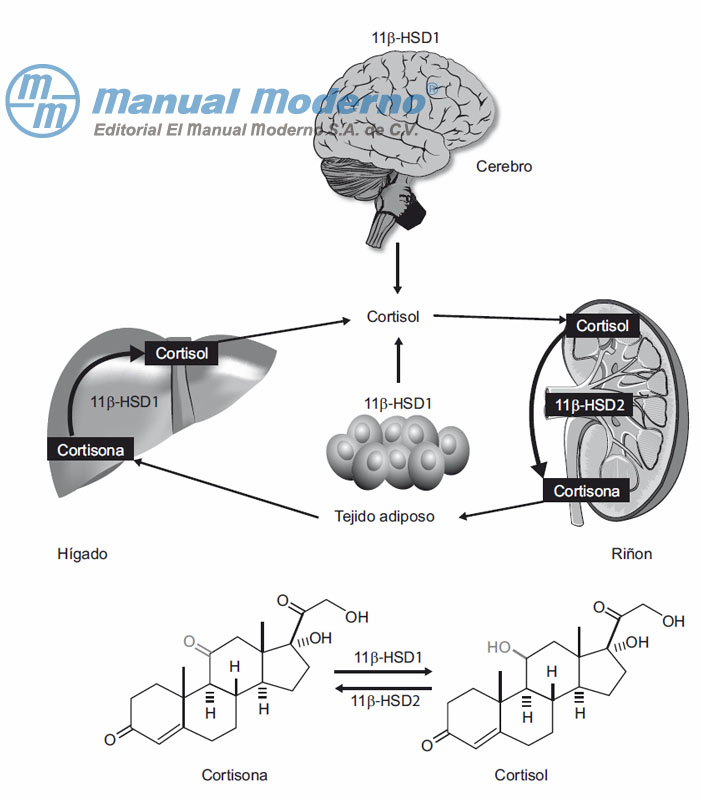
Figura 7-16. La 11?-hidroxiesteroide deshidrogenasa tipo 1 (11?-HSD1) cataliza la reducción de cortisona encortisol, en particular en hígado, cerebro y tejido adiposo; en cambio, la 11?-HSD2 cataliza la oxidación de cortisol a cortisona en riñones.
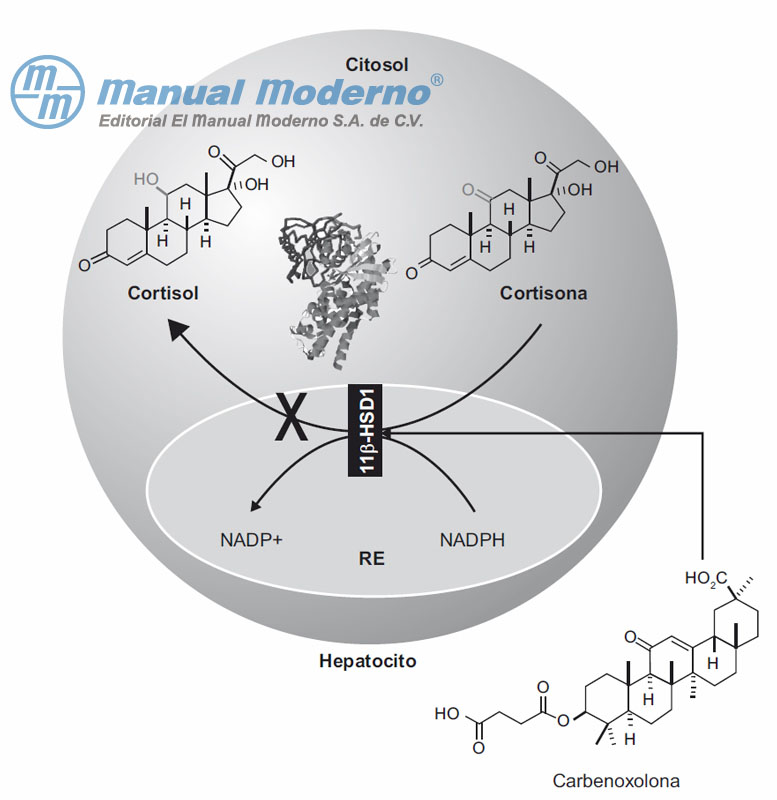
Figura 7-17. La carbenoxolona inhibe a la 11?-HSD1 y evita que ésta catalice la reducción de la cortisona en cortisol. RE, retículo endoplasmático.
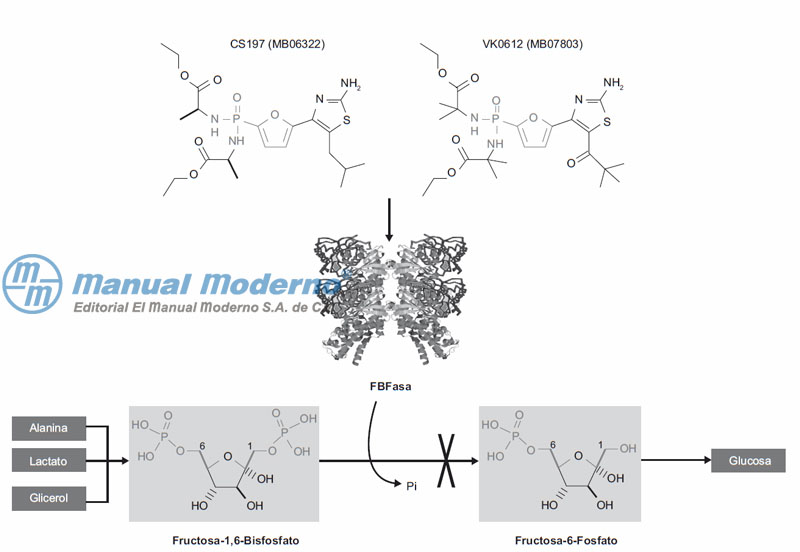
Figura 7-18. Esquema parcial de la gluconeogénesis que muestra la inhibición de la fructosa-1,6-bisfosfatasa (FBFasa) por los AMP miméticos CS-917 y VK0612 para impedir la conversión de fructosa-1,6-bifosfato (F1,6BF) en fructosa-6-fosfato (F6F) y evitar que se biosintetice glucosa.
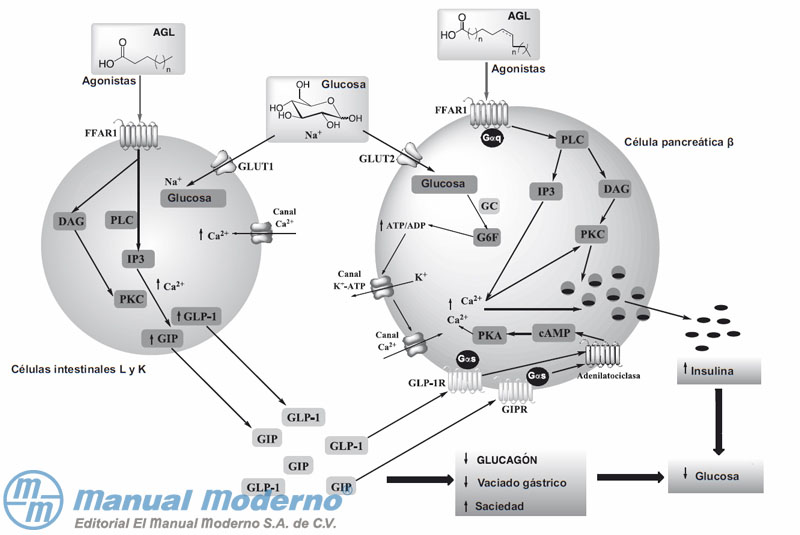
Figura 7-19. El receptor de ácidos grasos libres tipo 1 (FFAR1) es activado por agonistas endógenos (ácidos grasos libres, AGL) o sintéticos (TAK-875), tanto en células intestinales L y K como en pancreáticas ?; de ese modo se estimulan las vías de señalización para secretar insulina, el péptido 1 tipo glucagón (GLP-1) y el péptido insulinotrópico dependiente de glucosa (GIP).
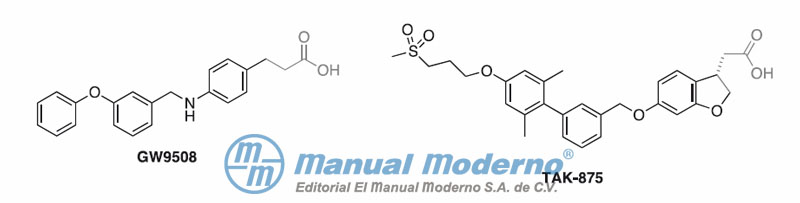
Figura 7-20. Agonistas del FFAR1 descontinuados de los estudios clínicos.
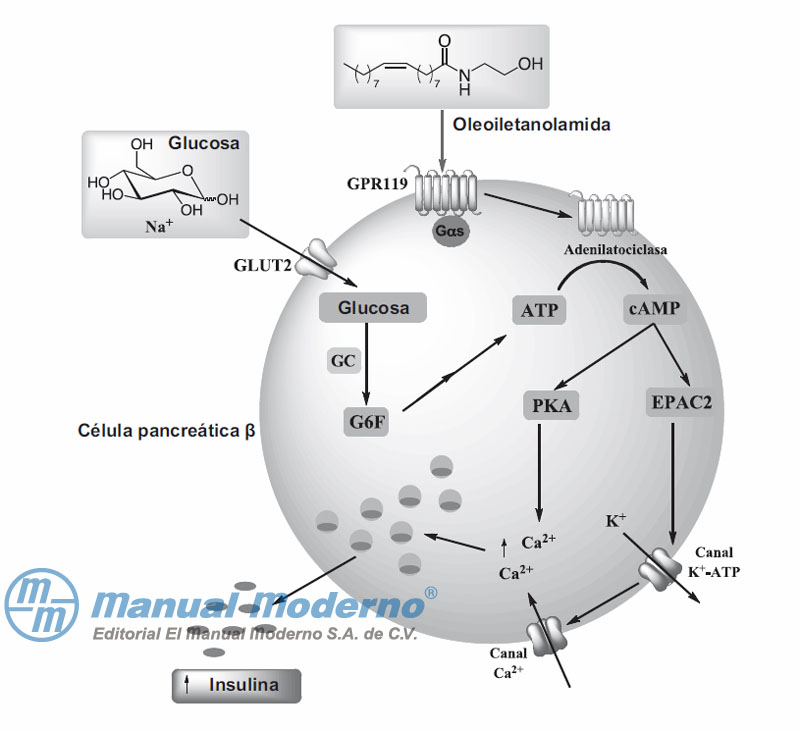
Figura 7-21. La activación del receptor 119 acoplado a proteína G (GPR119) promueve la secreción de insulina en las células pancreáticas ? a través de la activación de las proteínas PCA y EPAC2.
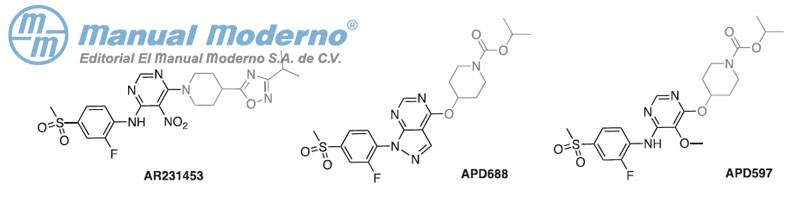
Figura 7-22. Agonistas del GPR119 descontinuados de los estudios clínicos.
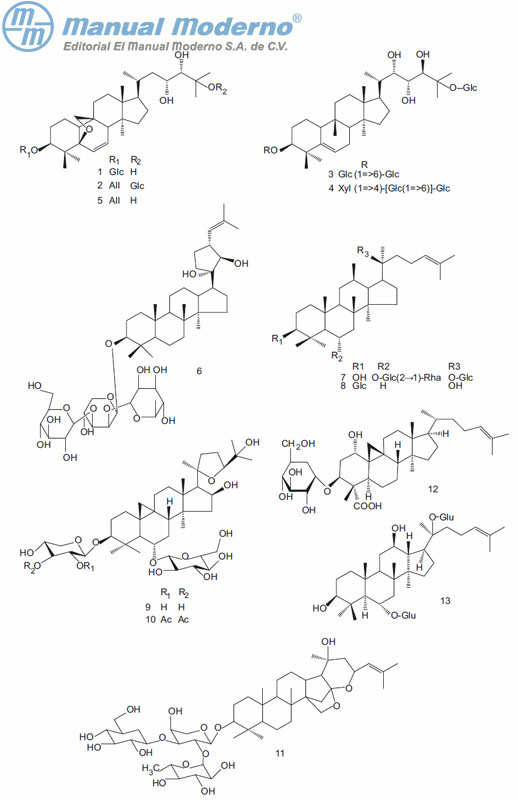
Figura 9-1. Saponinas con actividad antidiabética.
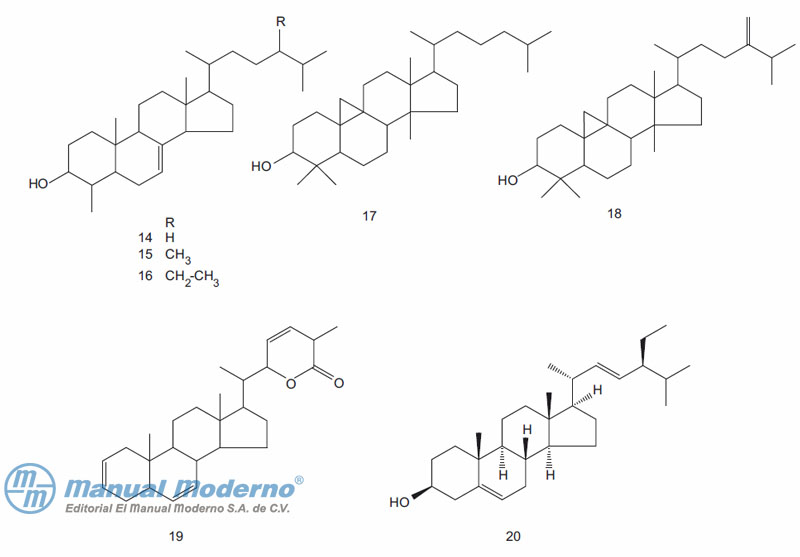
Figura 9-2. Esteroides con actividad antidiabética.

Figura 9-3. Terpenos con actividad antidiabética.
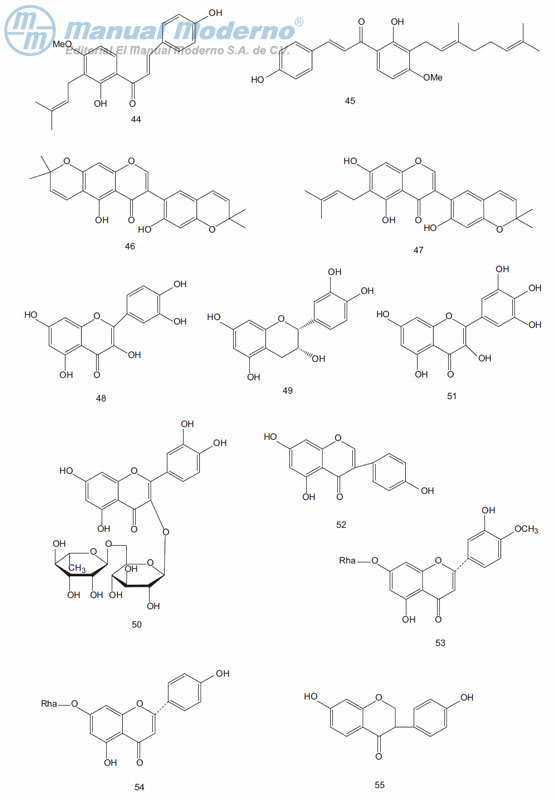
Figura 9-4. Flavonoides con actividad antidiabética.
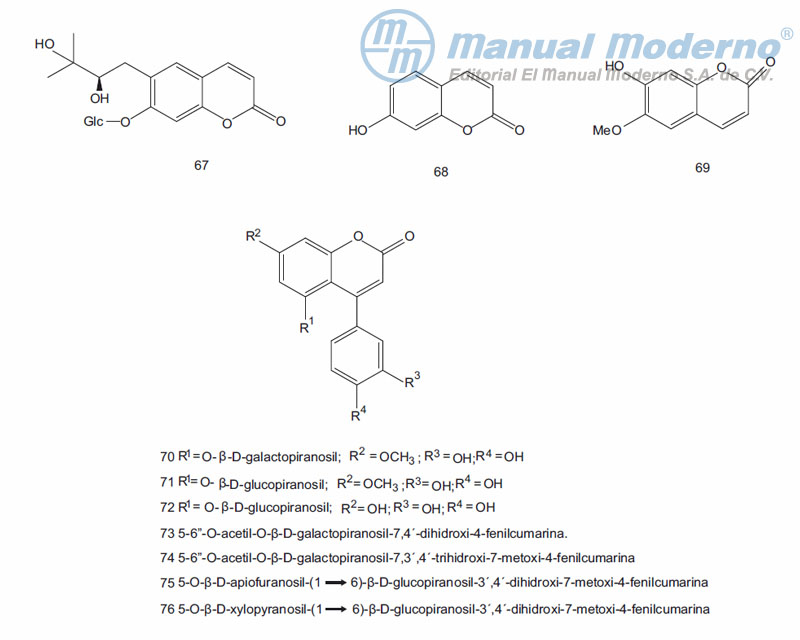
Figura 9-5. Cumarinas con actividad antidiabética.
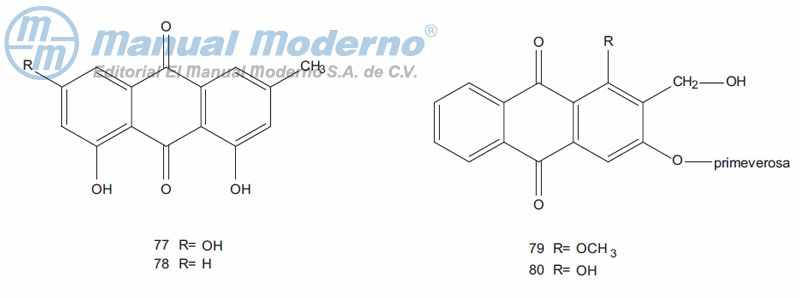
Figura 9-6. Antraquinonas con actividad antidiabética.
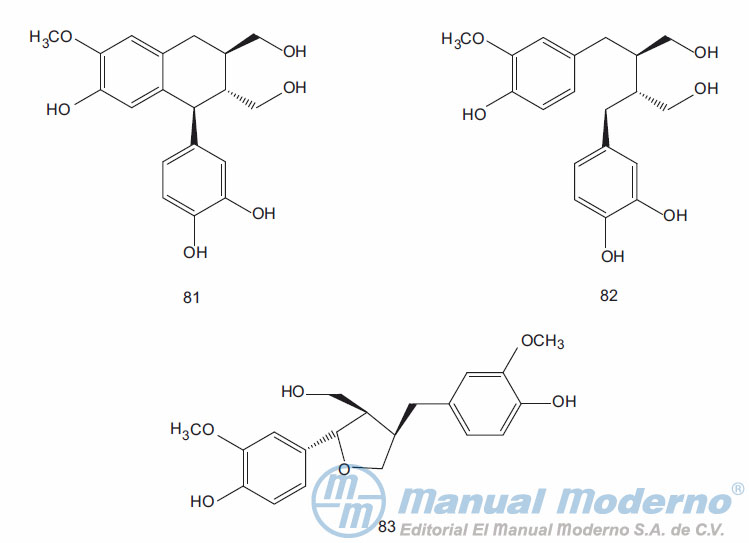
Figura 9-7. Lignanos con actividad antidiabética.
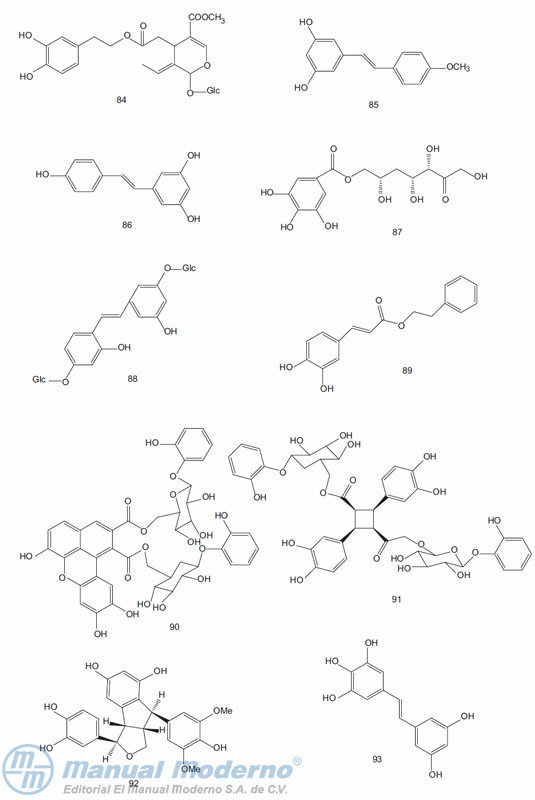
Figura 9-8_a. Compuestos fenólicos con actividad antidiabética.
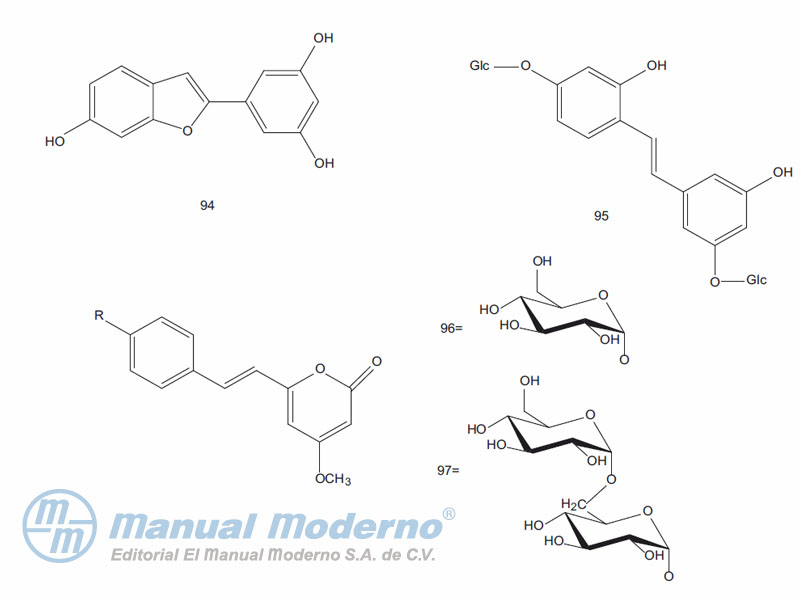
Figura 9-8_b. Compuestos fenólicos con actividad antidiabética.
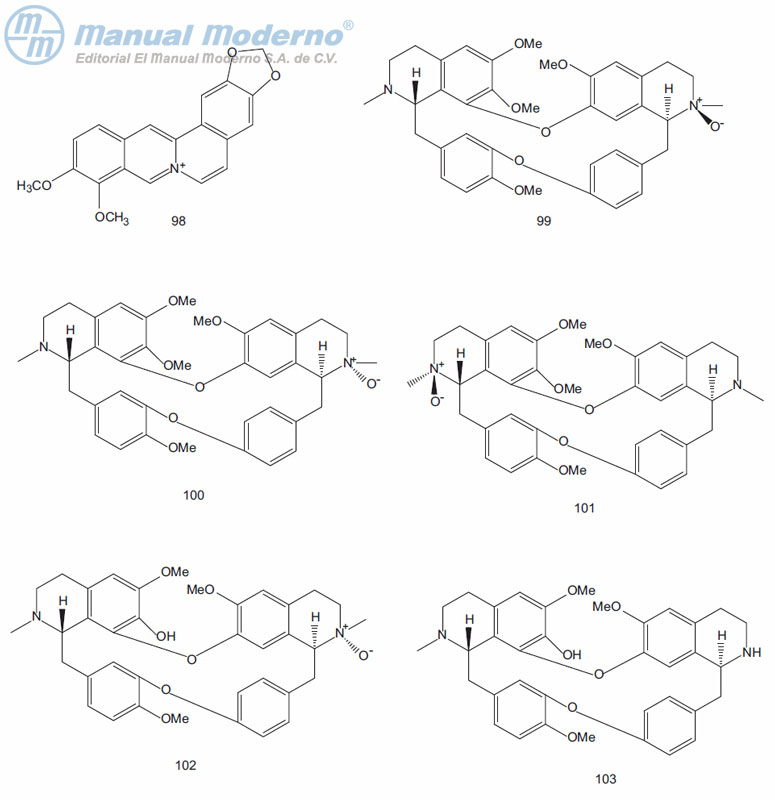
Figura 9-9. Alcaloides con propiedades antidiabéticas.
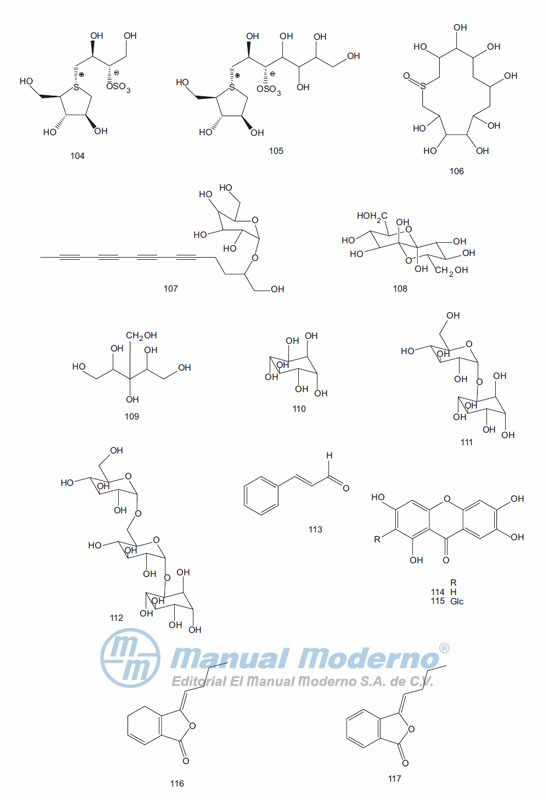
Figura 9-10. Otros compuestos con actividad antidiabética.
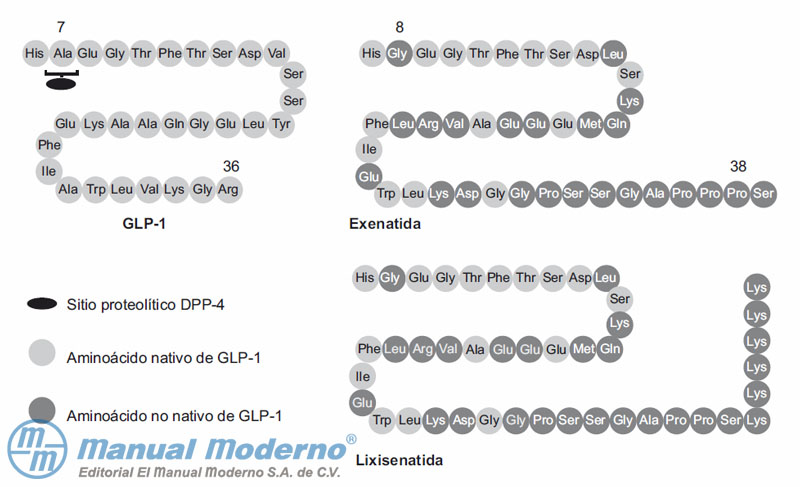
Figura 10-1. Similitudes y diferencias estructurales entre el péptido 1 tipo glucagón (GLP-1), exenatida y lixisenatida.
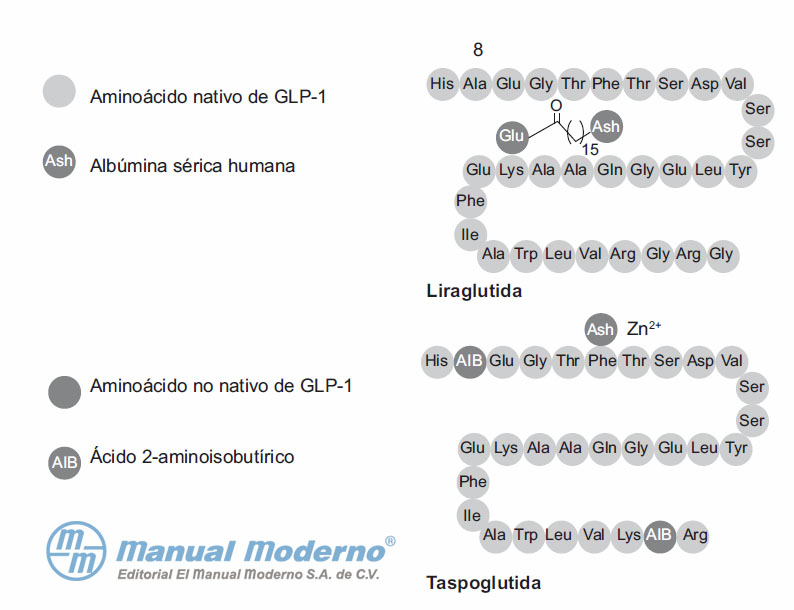
Figura 10-2. Similitudes y diferencias estructurales entre liraglutida y taspoglutida.
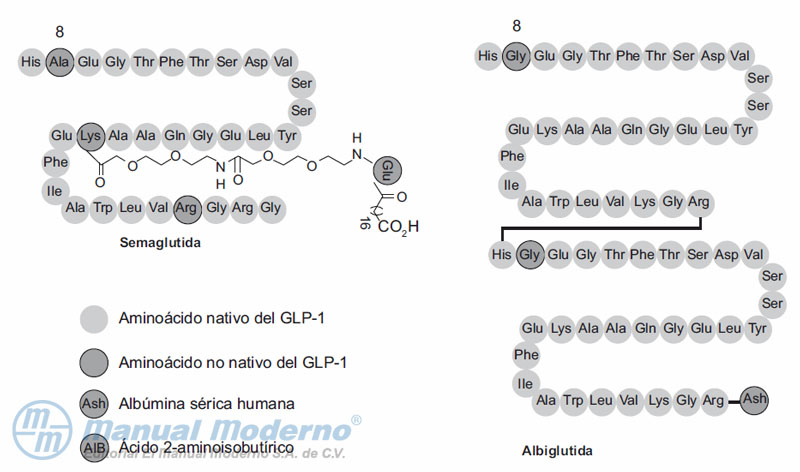
Figura 10-3. Similitudes y diferencias estructurales de semaglutida y albiglutida.
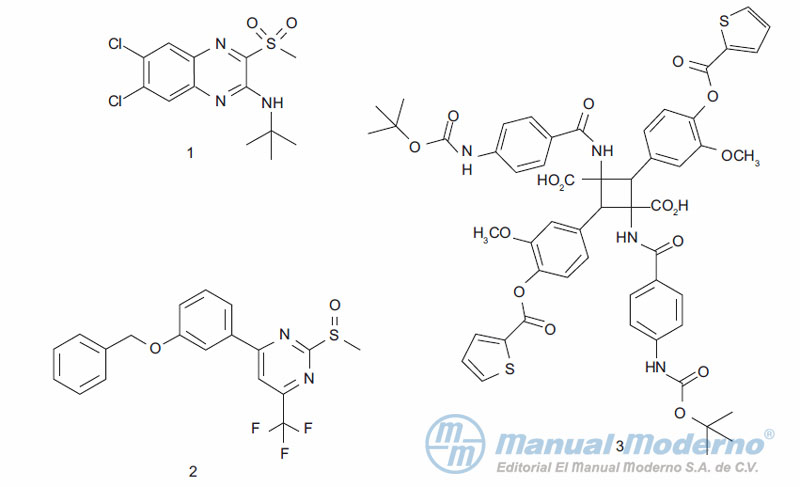
Figura 10-4. Agonistas no peptídicos del GLP-1.
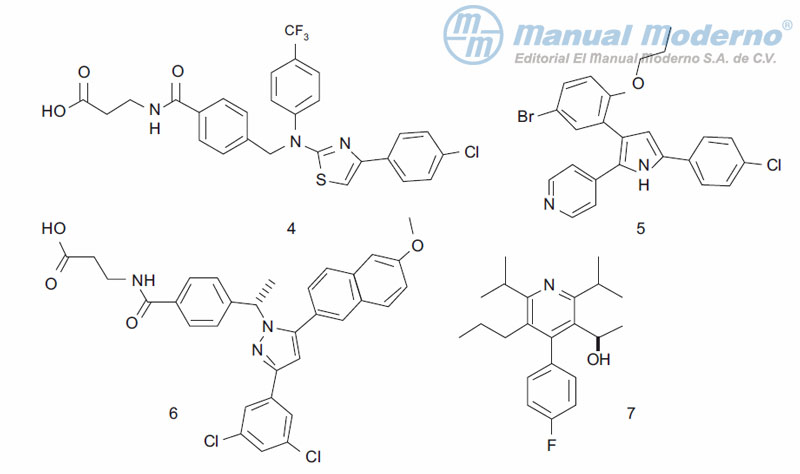
Figura 10-5. Antagonistas no peptídicos del glucagón humano.
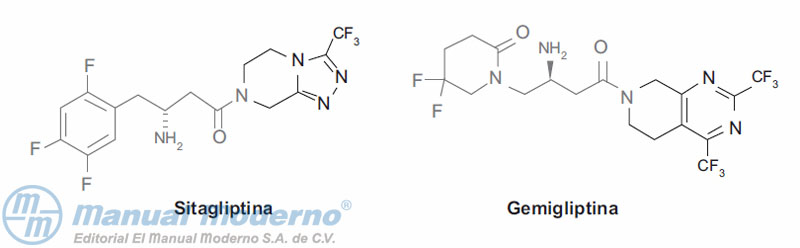
Figura 10-6. Inhibidores ?-amino amídicos de la dipeptidilpeptidasa 4.
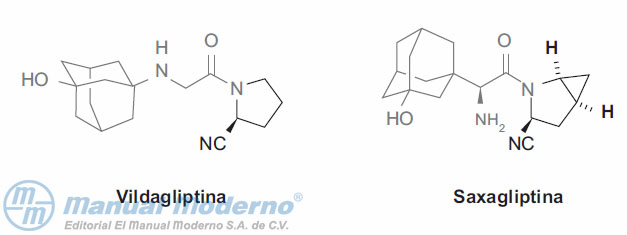
Figura 10-7. Inhibidores ?-amino amídicos de la dipeptidilpeptidasa 4.
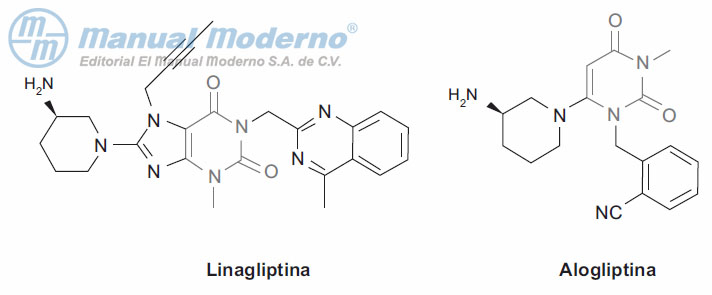
Figura 10-8. Inhibidores xantínicos de la dipeptidilpeptidasa 4.
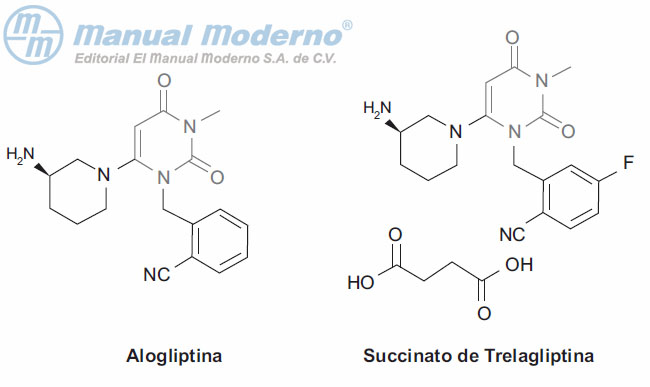
Figura 10-9. Inhibidores xantínicos de la dipeptidilpeptidasa 4.
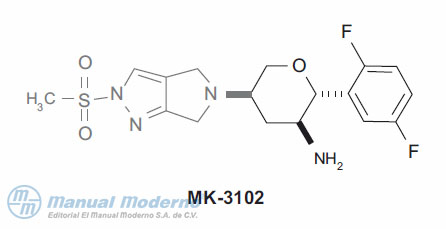
Figura 10-10. Inhibidor pirazolpirrolidínico de la dipeptidilpeptidasa 4.
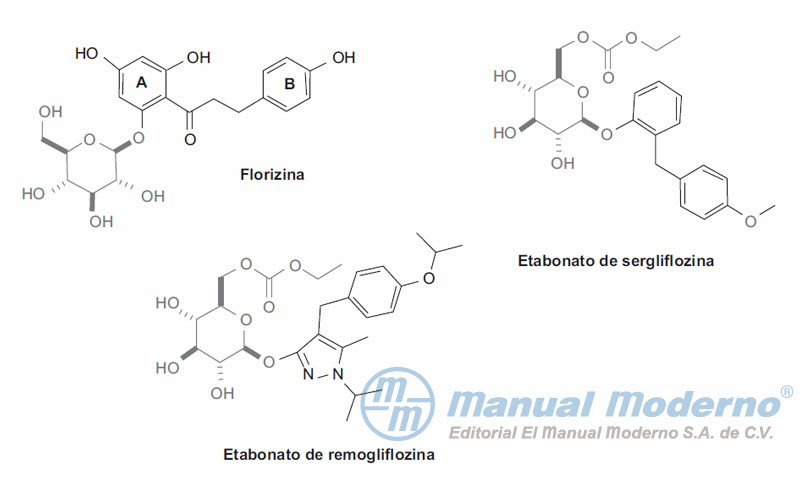
Figura 10-11. Inhibidores O-glucosídicos del cotransportador SGLT2.
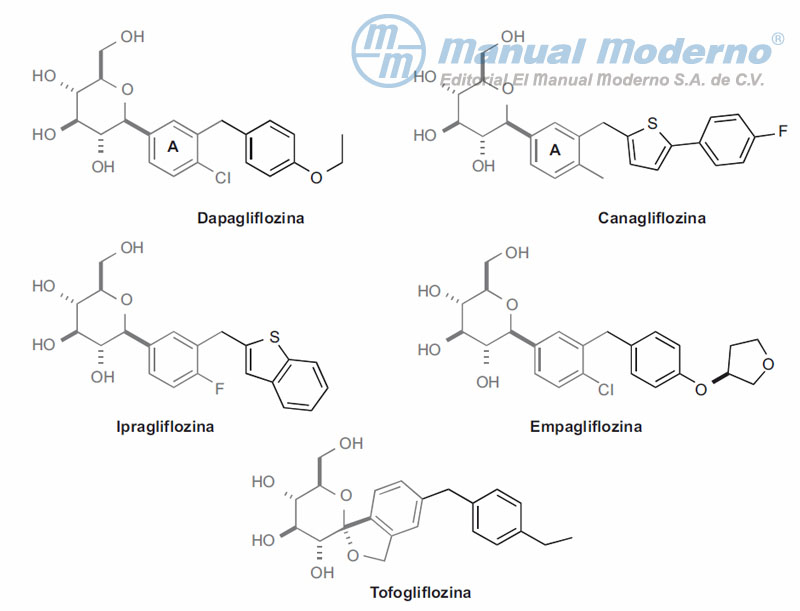
Figura 10-12. Inhibidores C-arilglucosídicos del cotransportador SGLT2.
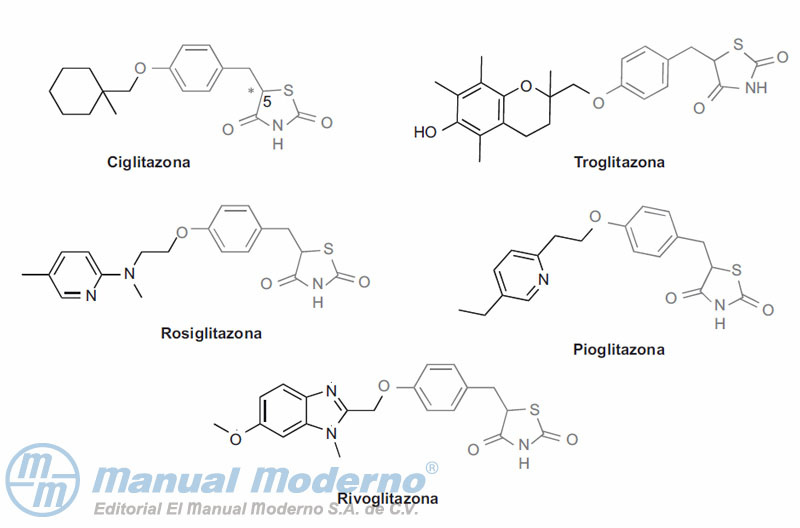
Figura 10-13. Agonistas potentes del receptor activado para proliferación de peroxisomas (PPAR?).
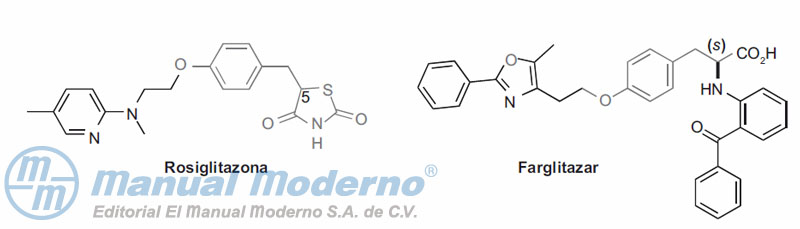
Figura 10-14. Agonistas potentes de PPAR?.
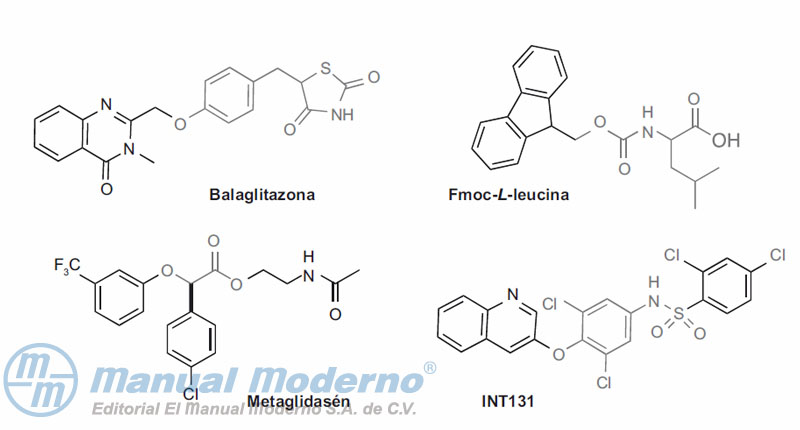
Figura 10-15. Agonistas parciales y moduladores selectivos de PPAR?.
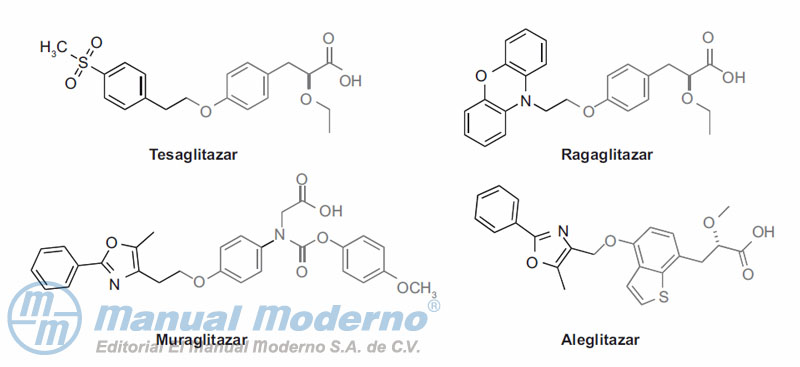
Figura 10-16. Agonistas duales de PPAR?/?.
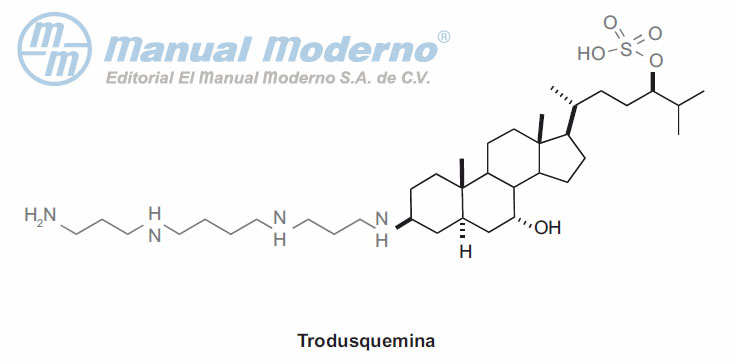
Figura 10-17. Inhibidor de la proteína-tirosina fosfatasa 1B.
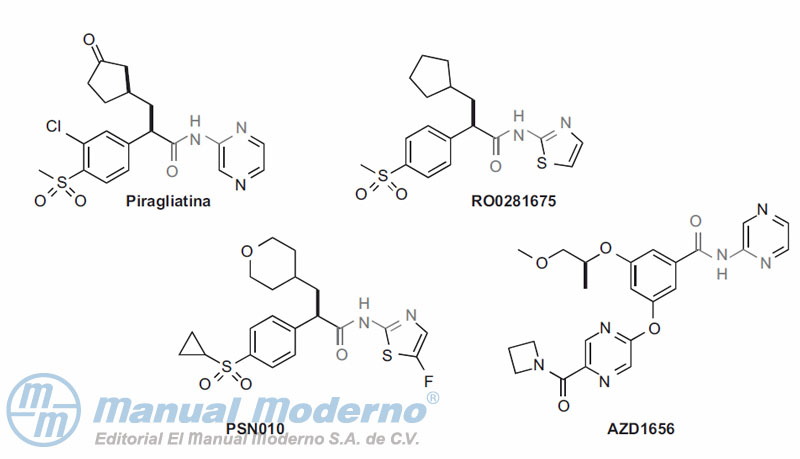
Figura 10-18. Activadores seleccionados de la glucocinasa.
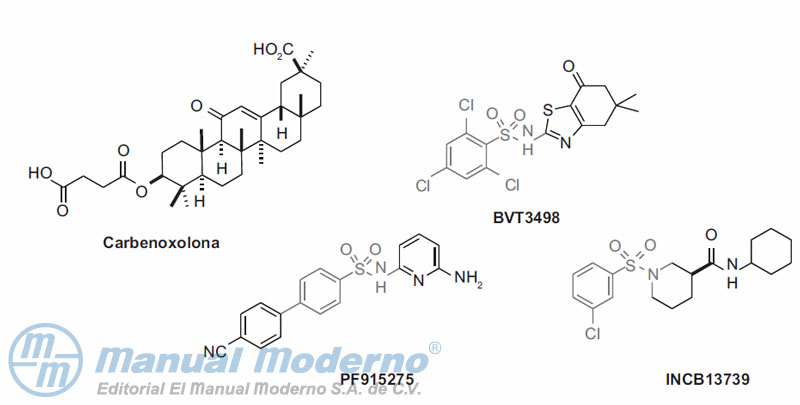
Figura 10-19. Activadores seleccionados de la glucocinasa.
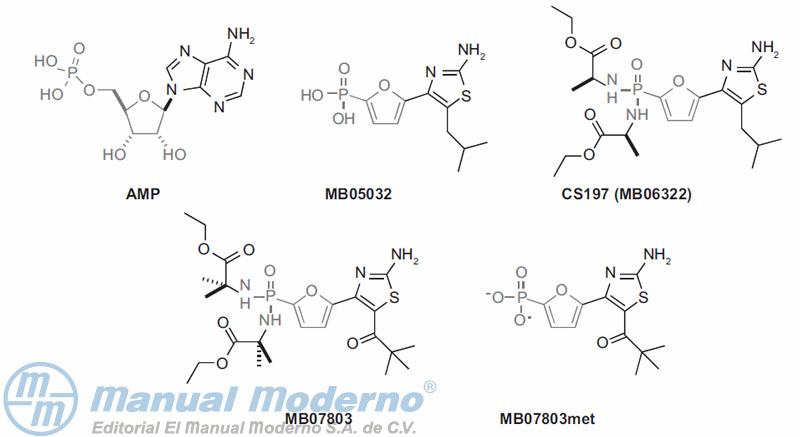
Figura 10-20. Inhibidores de la fructosa-1,6-bisfosfatasa.
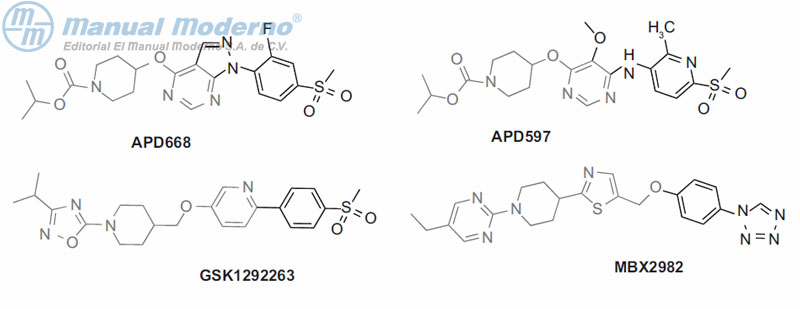
Figura 10-21. Agonistas del receptor 119 acoplado a proteína G.
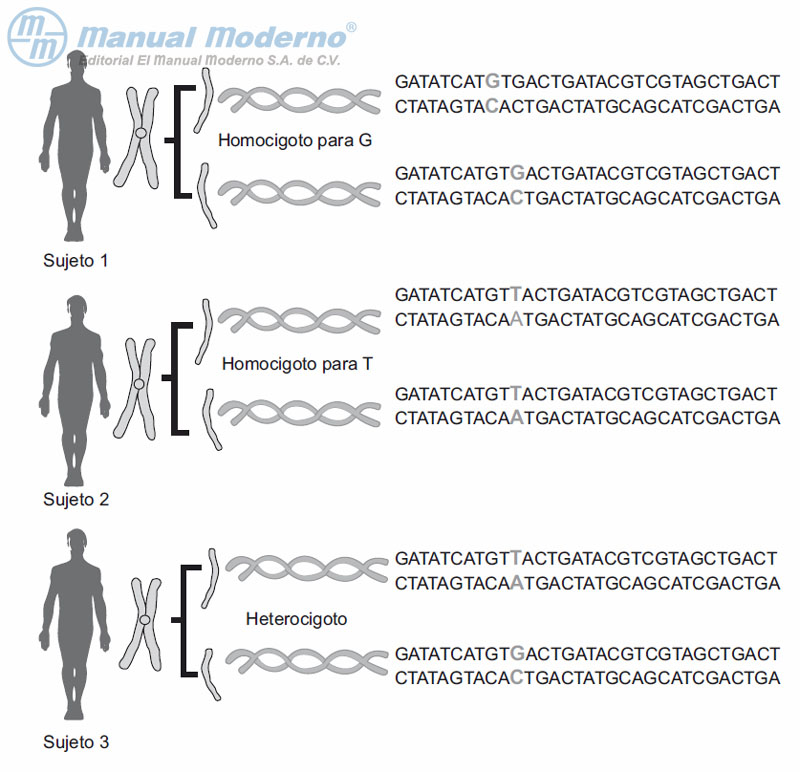
Figura 11-1. Polimorfismos de nucleótido único. Puesto que son organismos diploides, cada ser humano posee al menos dos copias de cada gen, uno en cada miembro del par de cromosomas (excepto algunos genes de los cromosomas sexuales). Los SNP son variaciones de un solo nucleótido que pueden generar tres clases de genotipos diferentes de acuerdo con este principio. En consecuencia, un sujeto puede tener en sus dos copias del gen ambos nucleótidos de un tipo, o incluso del otro (homocigotos), o uno diferente en cada cromosoma (heterocigoto).
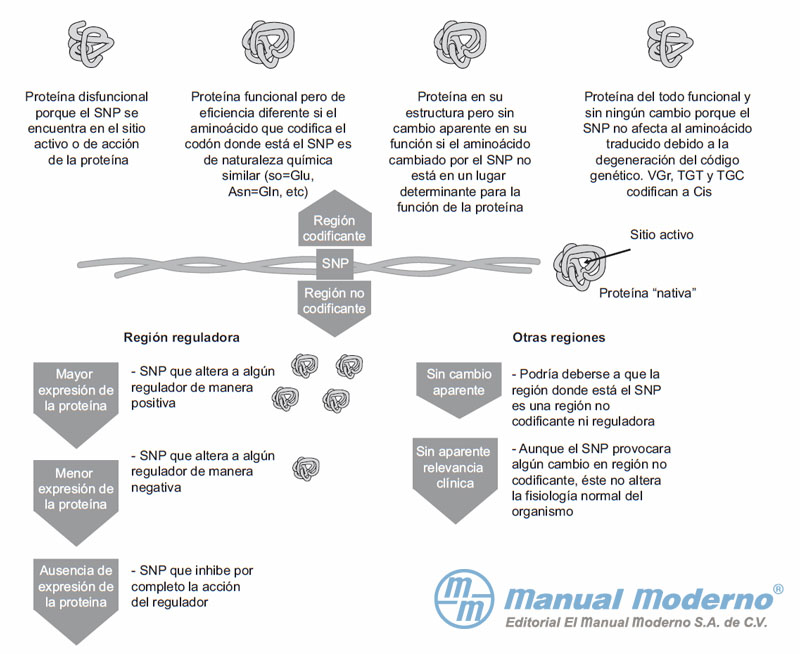
Figura 11-2. Efectos de los SNP sobre la expresión de proteínas y su consecuente actividad biológica.
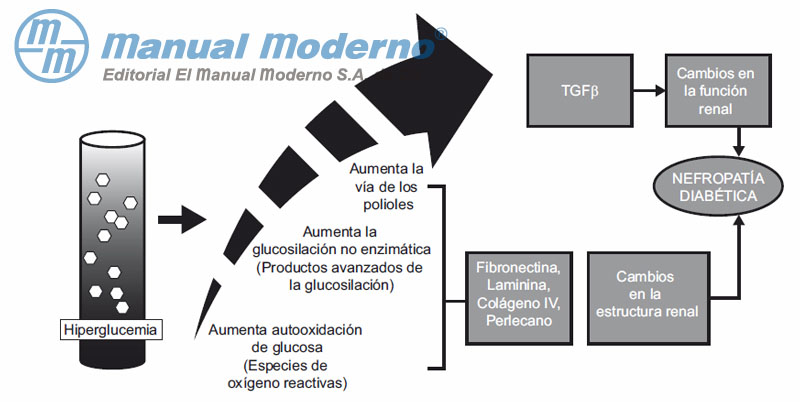
Figura 11-3. Vías metabólicas durante la hiperglucemia que modifi can el funcionamiento y la estructura renal.
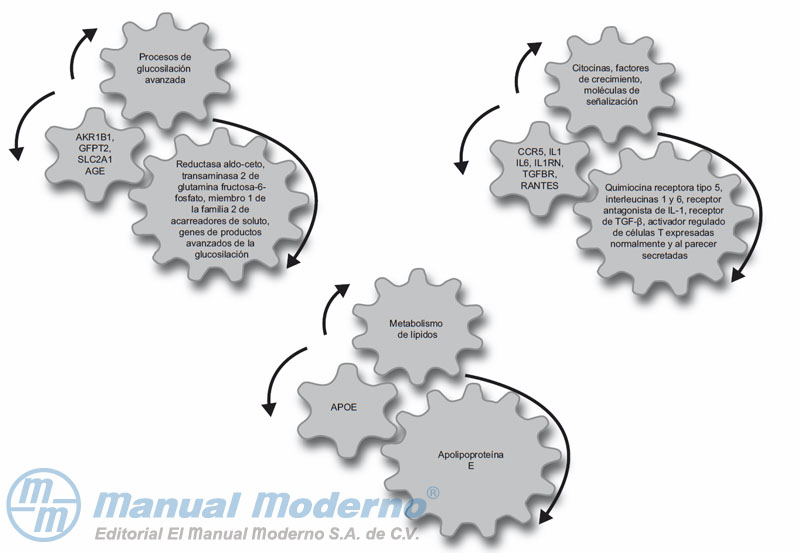
Figura 11-4_a. Genes posibles para valorar su relación con la nefropatía diabética.
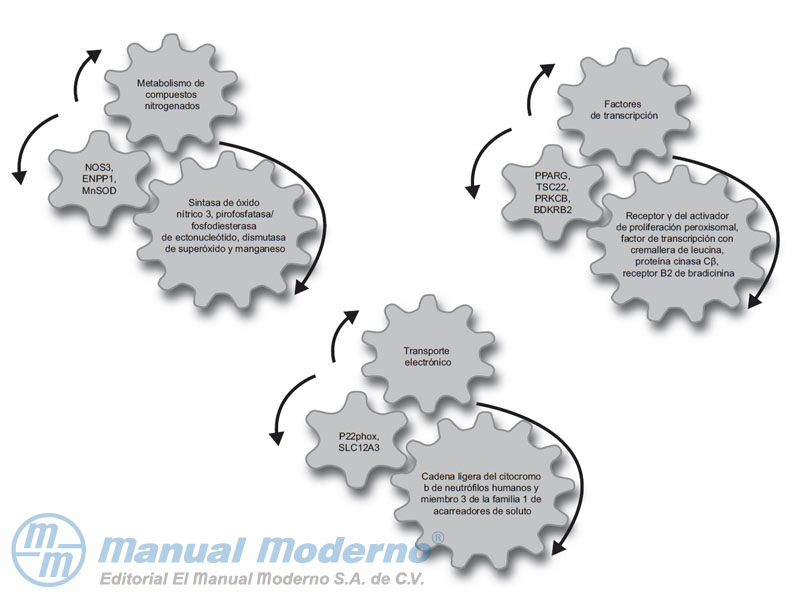
Figura 11-4_b. Genes posibles para valorar su relación con la nefropatía diabética.
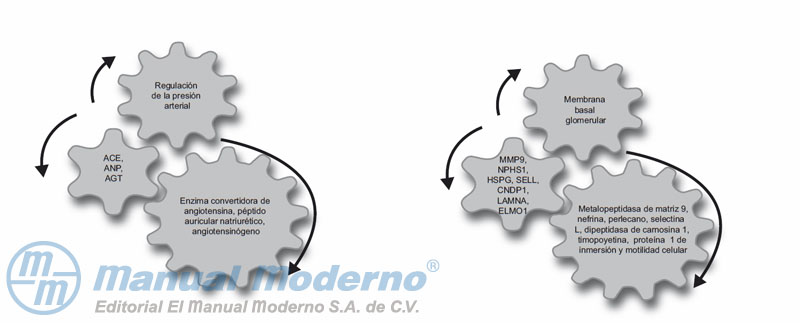
Figura 11-4_c. Genes posibles para valorar su relación con la nefropatía diabética.
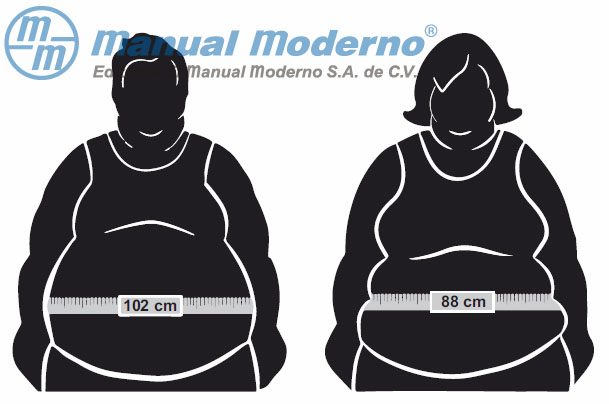
Figura 12-1. Representación de los valores umbrales por género para el perímetro de la cintura. (Cortesía de Juan Antonio Cantú Yeverino.)
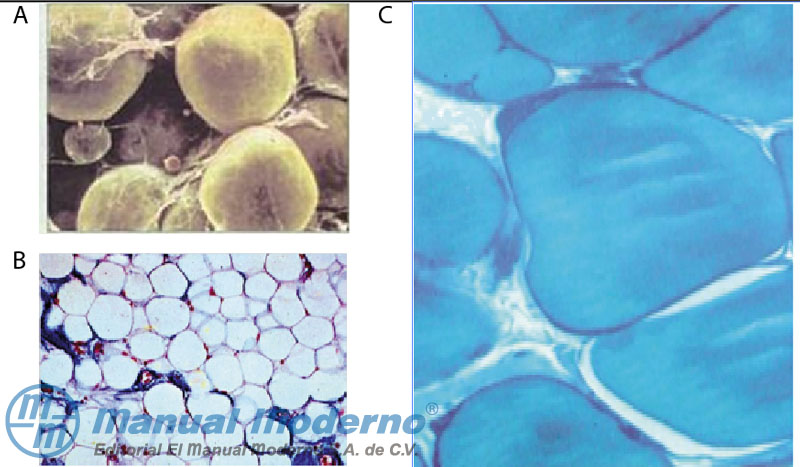
Figura 13-1. A. Imagen de adipocitos en el microscopio electrónico de barrido. B. Células adiposas en parafina (tejido subcutáneo) que forman un lobulillo adiposo. C. Adipocitos teñidos con azul de toluidina.
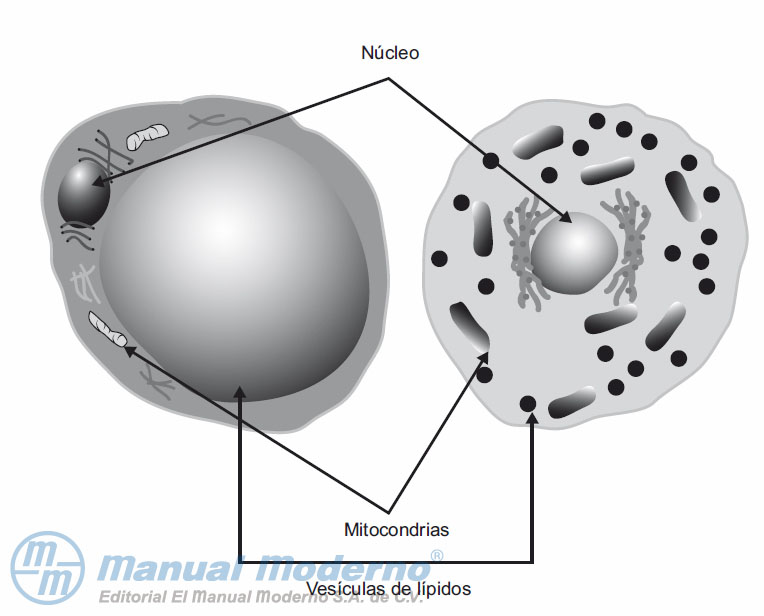
Figura 13-2. Morfología de los adipocitos blanco (izquierda) y pardo (derecha).
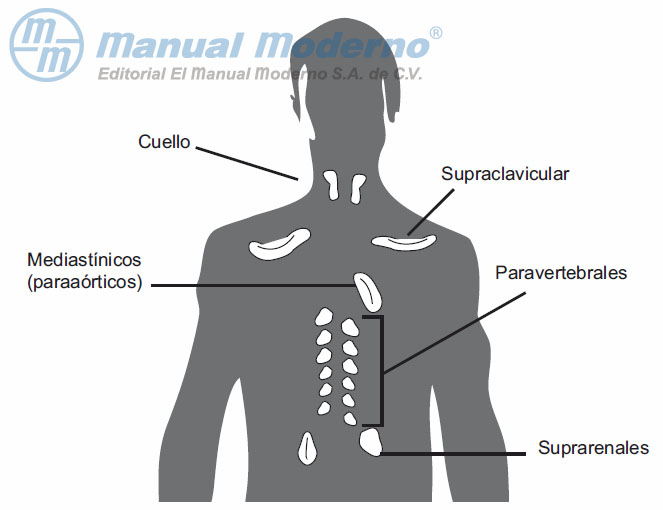
Figura 13-3. Localización del tejido adiposo pardo en el adulto.
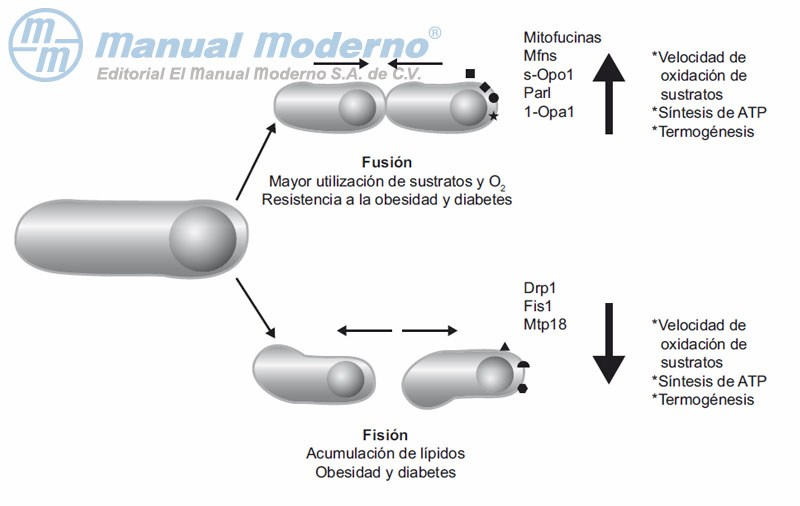
Figura 13-4. Esquema hipotético de la interacción entre morfología y metabolismo mitocondriales. OPA1, opticatrophy gene 1; Drp1, dynamin related protein 1; Mfns, mitofusinas; Fis 1, fission 1 homologue protein; Parl, presenilin-associated rhomboid-like protein; Mtp18, proteína de 18 kDa, cuya actividad enzimática no está bien definida, pero se presupone una acción coordinada en la fisión mitocondrial, dependiente de Drp1 y Fis1, debido a su localización en el espacio intermembranal.
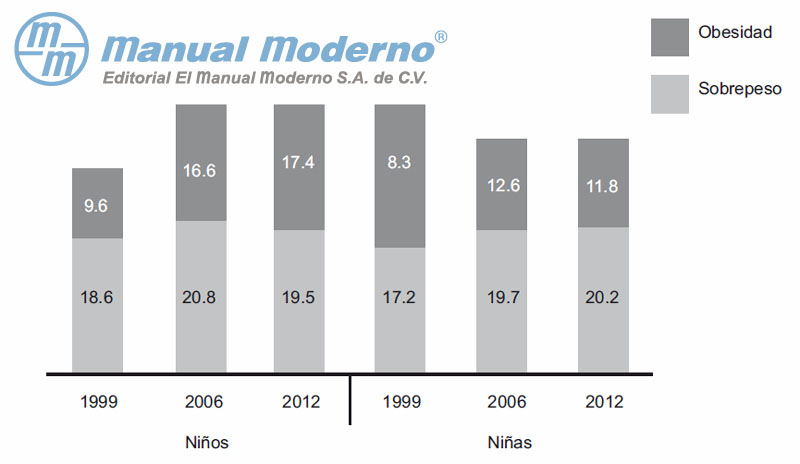
Figura 15-1. Prevalencia de obesidad infantil (5 a 11 años). (Datos tomados de ENSANUT 2012.)2012).
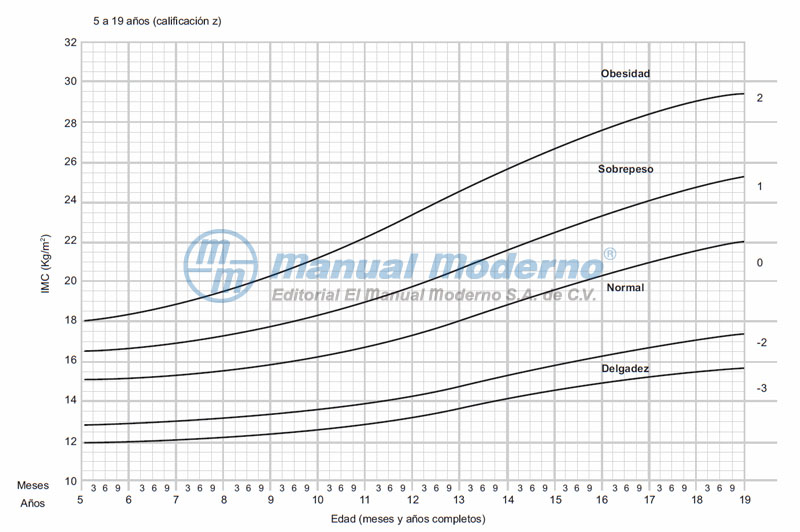
Figura 15-2_a. Índice de masa corporal infantil ajustado por edad y género (hombres). Reproducido con autorización de: World Health Organization: BMI-for-age BOYS, 2007 WHO Reference.
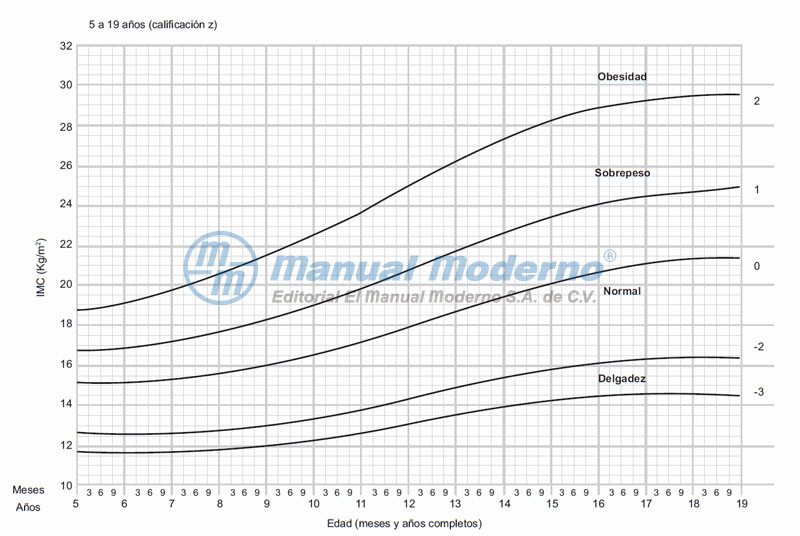
Figura 15-2_b. Índice de masa corporal infantil ajustado por edad y género (hombres). Reproducido con autorización de: World Health Organization: BMI-for-age BOYS, 2007 WHO Reference.

Figura 16-1. A la izquierda se muestra la bolsa que se introduce en la técnica del balón intragástrico; a la derecha se representa la forma en que éste ocupa una porción grande del estómago.
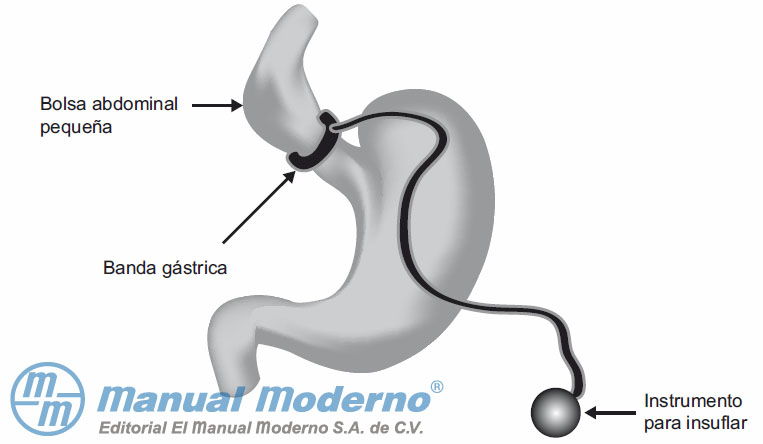
Figura 16-2. Representación de la banda gástrica ajustable.
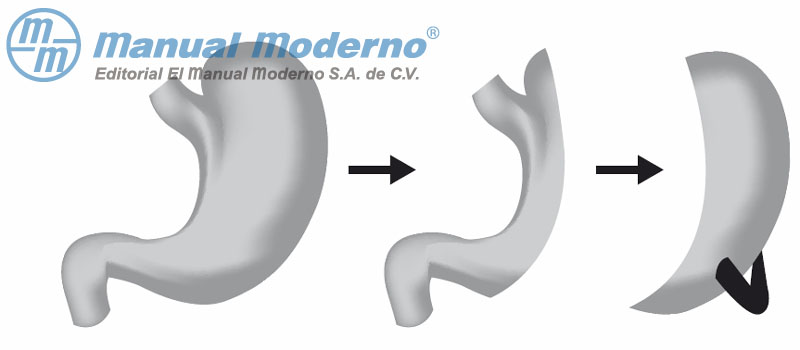
Figura 16-3. Esquema de la manga gástrica.
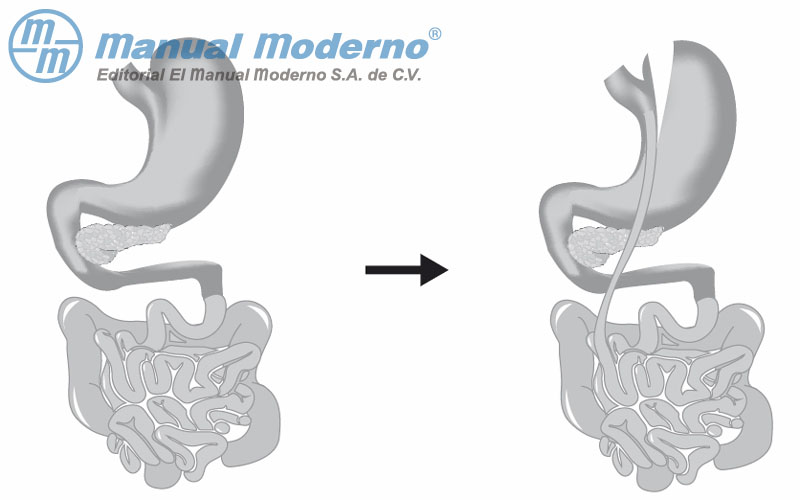
Figura 16-4. Representación de la derivación gástrica.
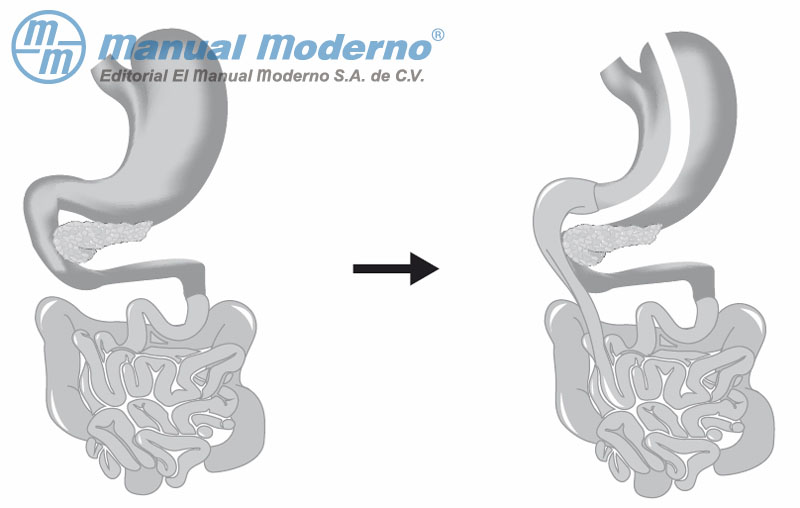
Figura 16-5. Representación del cruce duodenal.
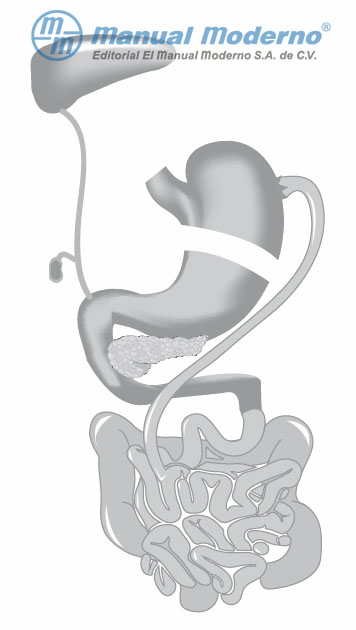
Figura 16-6. Representación de la derivación biliopancreática.
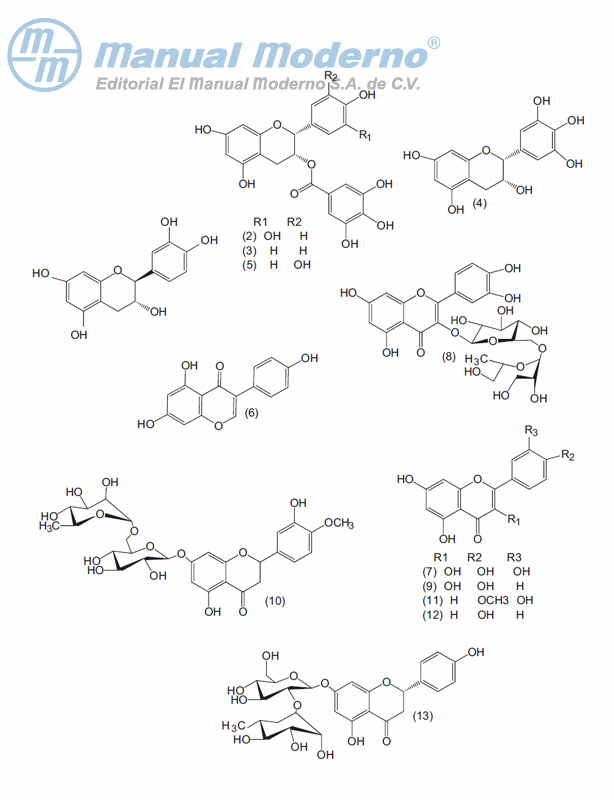
Figura 17-1. Flavonoides con actividad antiobesidad.
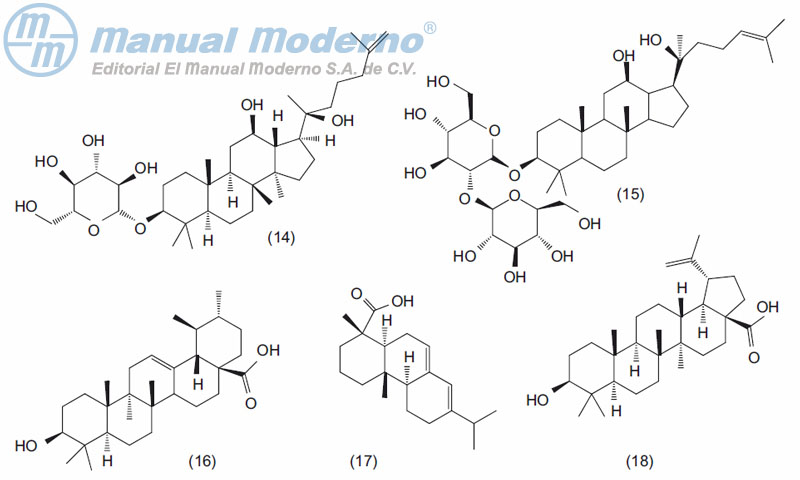
Figura 17-2. Terpenos con actividad antiobesidad.
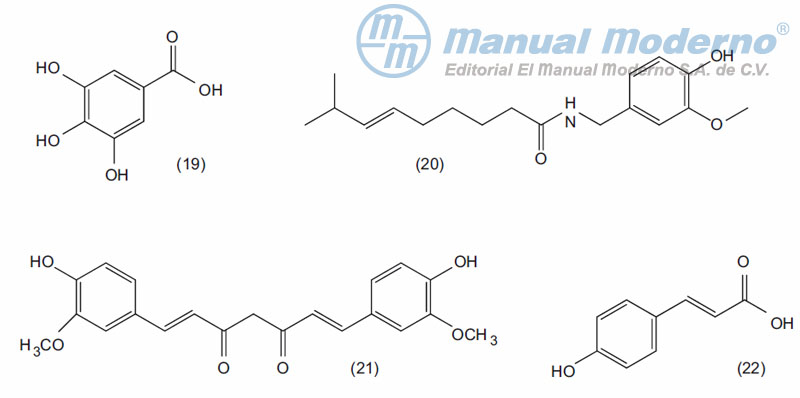
Figura 17-3. Compuestos fenólicos con actividad antiobesidad.
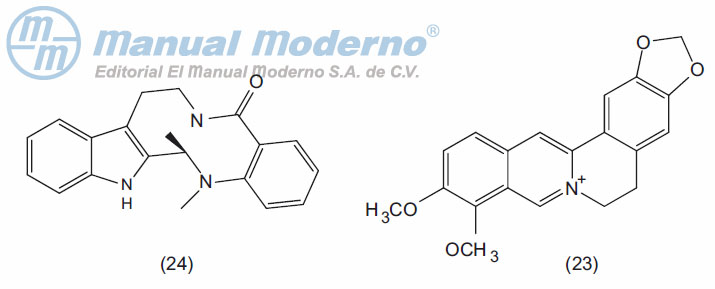
Figura 17-4. Alcaloides con actividad antiobesidad.
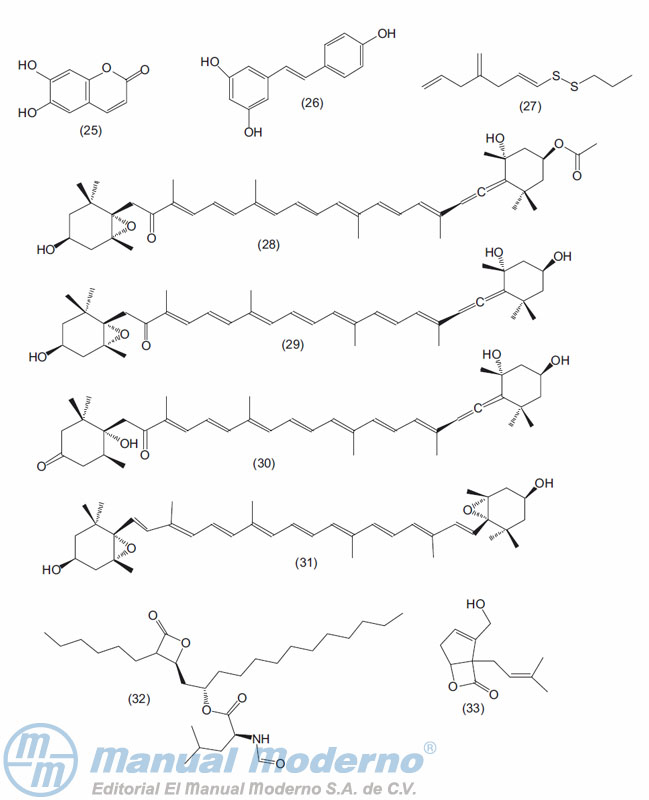
Figura 17-5. Otros compuestos con actividad antiobesidad.
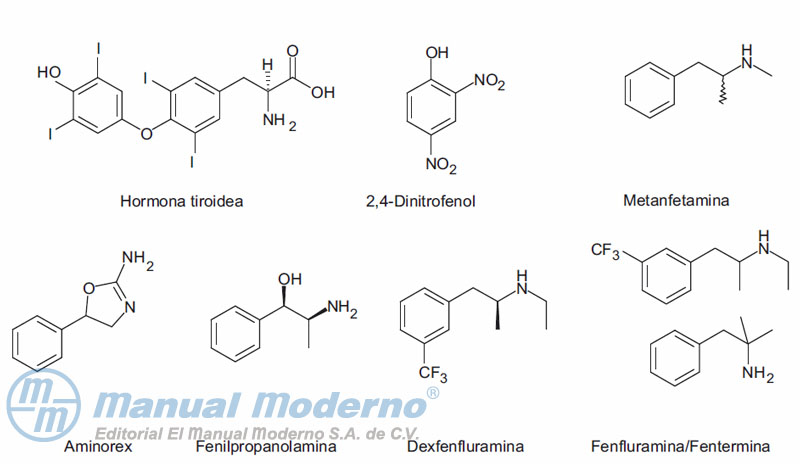
Figura 18-1. Fármacos utilizados para el tratamiento de la obesidad en desuso.
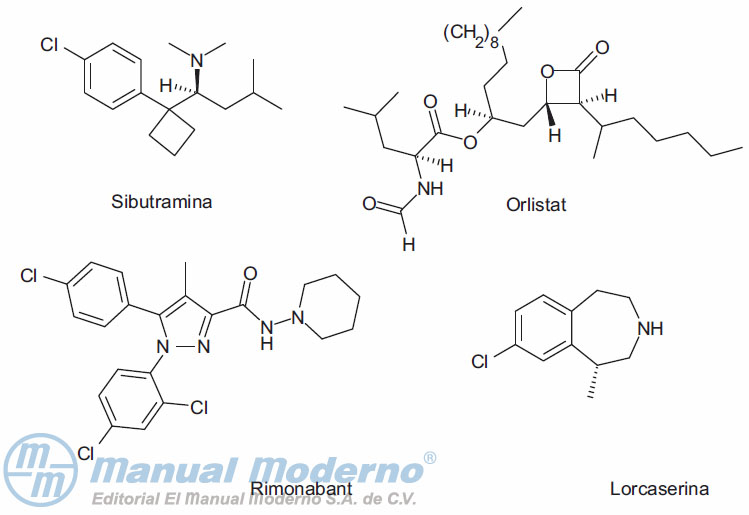
Figura 18-2. Fármacos empleados para el tratamiento de la obesidad en uso.
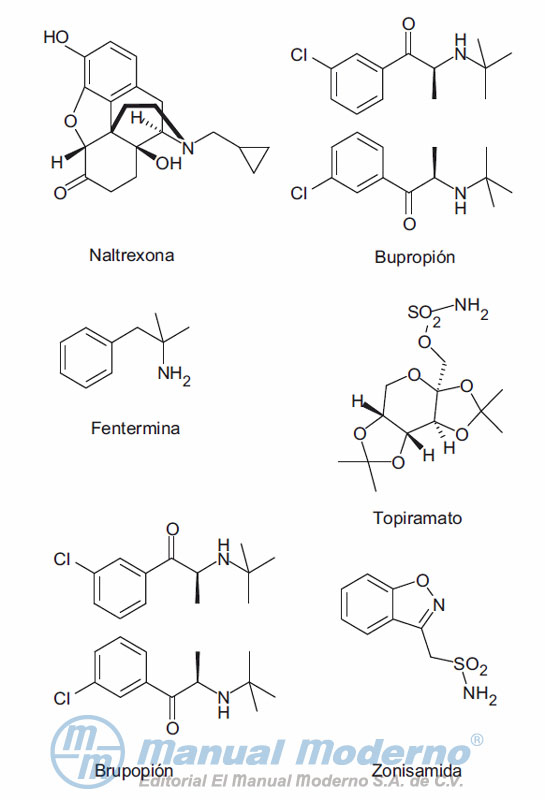
Figura 18-3. Fármacos utilizados en combinación para el tratamiento de la obesidad en uso.
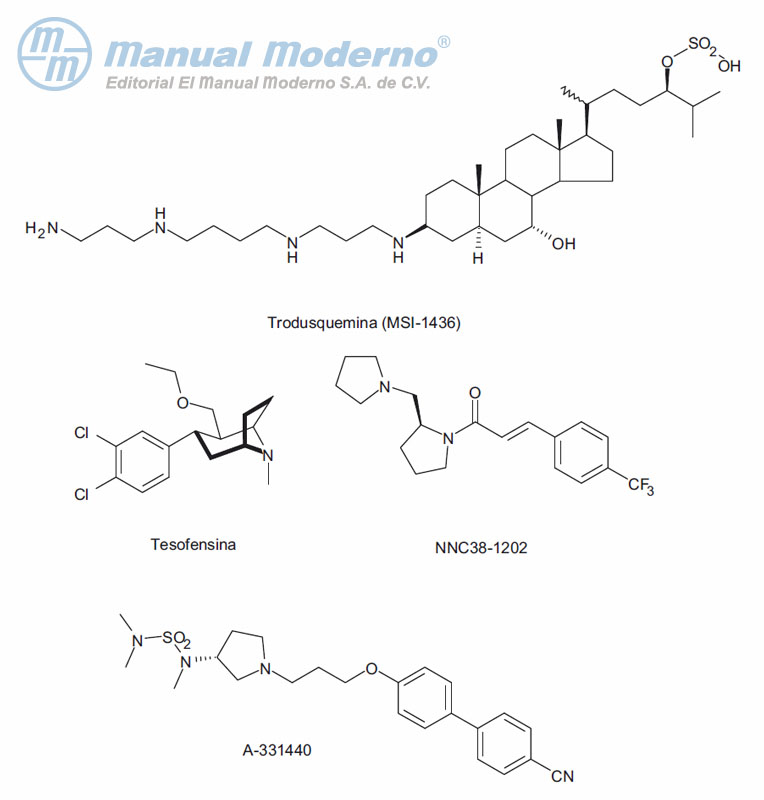
Figura 18-4. Fármacos en desarrollo con potencial uso para el tratamiento de la obesidad.
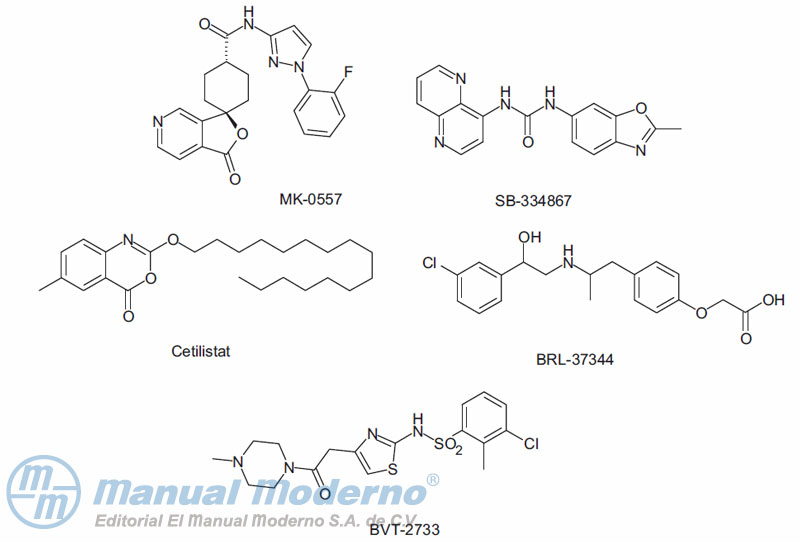
Figura 18-5. Fármacos con probable uso para el tratamiento de la obesidad en estudios clínicos.



