-
Figura 1.5.6C. Aspecto endoscópico de la esofagitis eosinofílica: esófago en “papel crepé”.
-
Figura 1.6.6E. Pseudoacalasia por neoplasia de la unión esofagogástrica.
-
Figura 1.7.8A. B) Acalasia: tres tipos de acalasia identificados con manometría de alta resolución.
-
Figura 1.8.9.2A. Carcinoma circunferencial de esófago con desarrollo de fístula esofagomediastínica.
-
Figura 1.8.9.2B. Prótesis metálica cubierta autoexpandible en el plano esofágico.
-
Figura 1.10.3A. Imagen endoscópica de un divertículo del tercio medio.
-
Figura 4.7.7A. Imagen endoscópica del colon sigmoides con divertículos.
-
Figura 4.7.7B. Colon por enema que muestra imágenes características de divertículos.
-
Figura 4.8.8A. Aspecto de un pólipo identificado por colonoscopia.
-
Figura 4.9.5C. Imagen de un adenocarcinoma en colon diagnosticado por cápsula endoscópica colónica.
-
Figura 6.7.9A. Imagen ultrasonográfica de una esteatosis hepática.
-
Figura 6.7.9B. Características histológicas de la EHGNA. A. Esteatosis simple. B. Esteatohepatitis.
![]() Sección 6. Hígado y vías biliares
Sección 6. Hígado y vías biliares
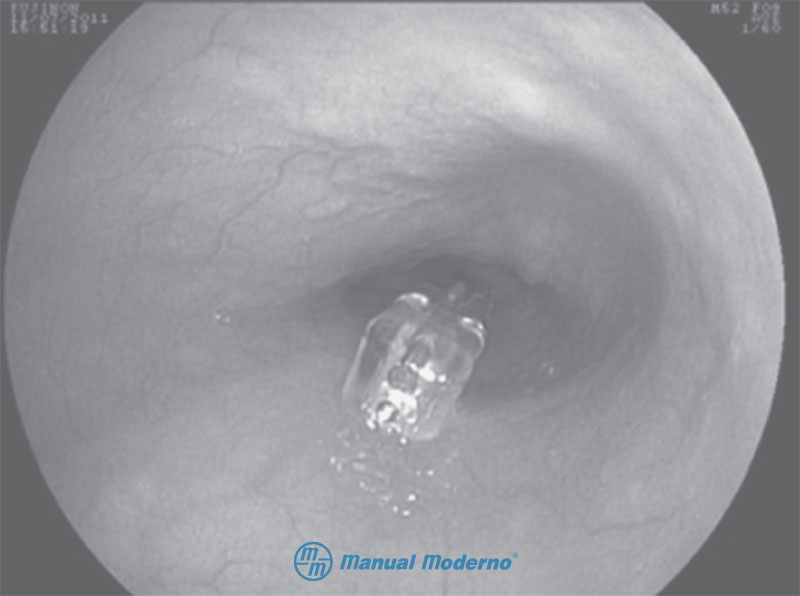
Figura 1.3.11B. Aspecto endoscópico de un paciente con cápsula Bravo® para la medición inalámbrica del pH.
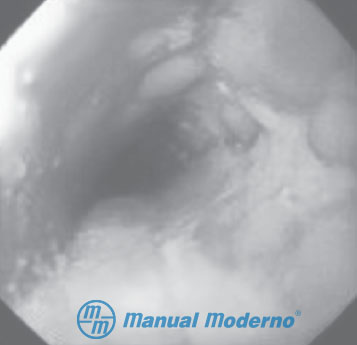
Figura 1.3.12A. Aspecto endoscópico de un paciente con esofagitis por reflujo de grado D (úlceras confluentes, fragilidad y edema).
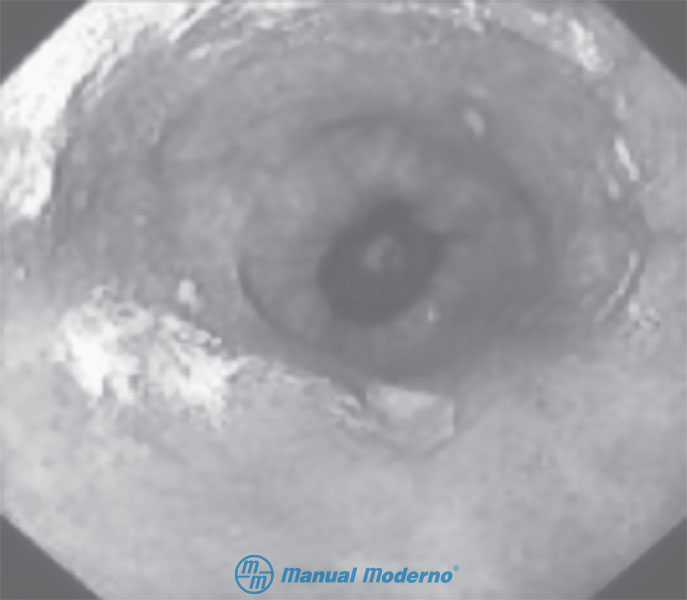
Figura 1.4.6A. Aspecto endoscópico de un paciente con esófago de Barrett. Obsérvense las lengüetas de mucosa ectópica que se extienden de manera proximal en el esófago.
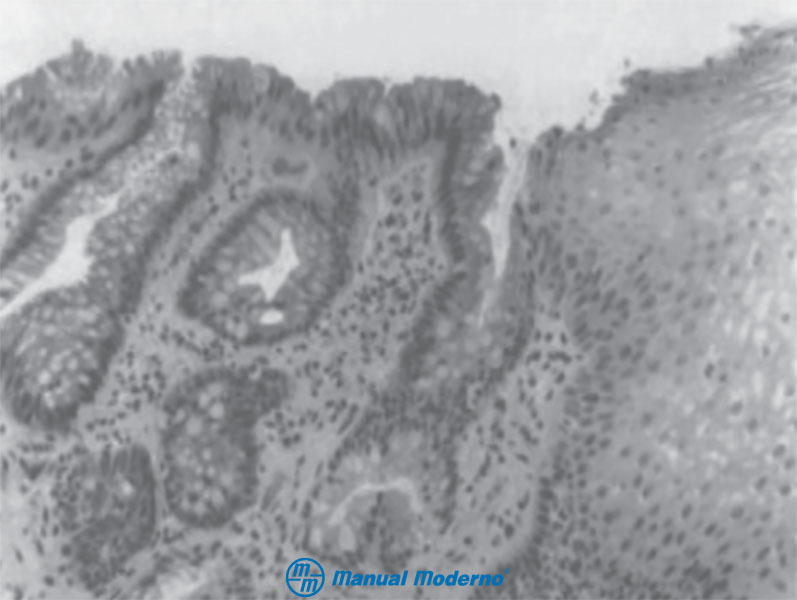
Figura 1.4.6B. Histopatología que muestra metaplasia intestinal especializada con epitelio columnar y las células caliciformes características. A la derecha de la fotomicrografía se identifica mucosa esofágica escamosa normal.
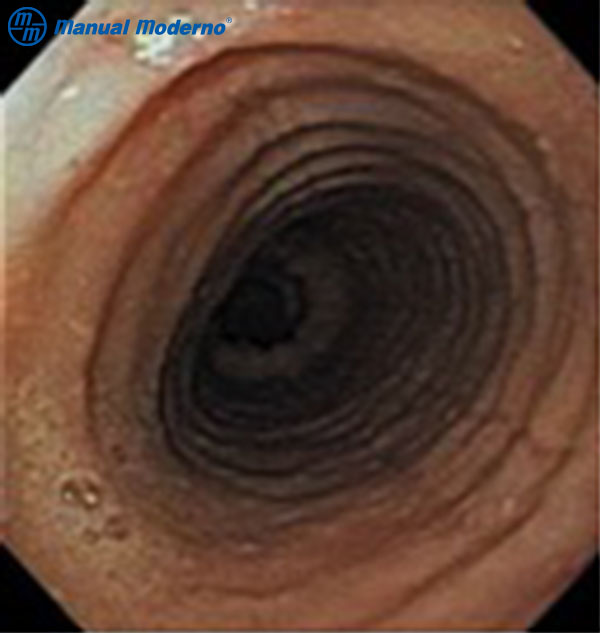
Figura 1.5.6A. Aspecto endoscópico de la esofagitis eosinofílica: anillos concéntricos (esófago traquealizado).
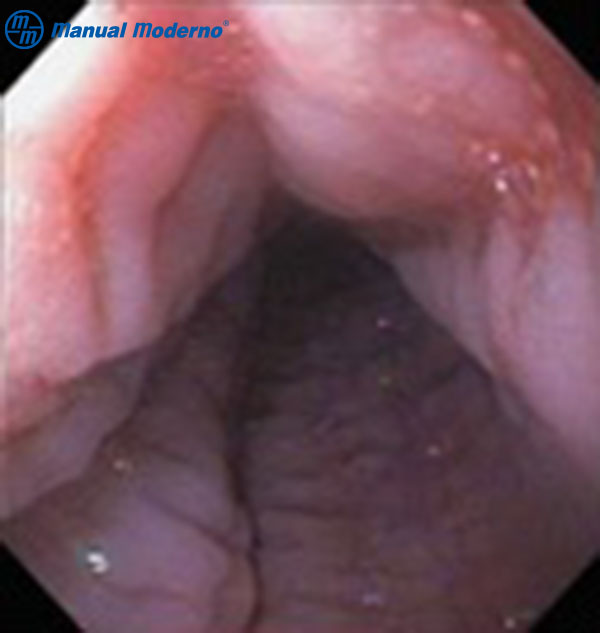
Figura 1.5.6B. Aspecto endoscópico de la esofagitis eosinofílica: surcos longitudinales (felinización).
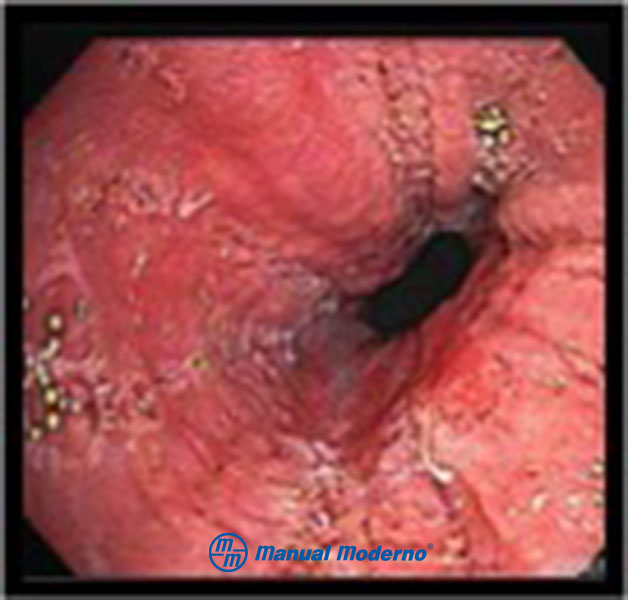
Figura 1.5.6C. Aspecto endoscópico de la esofagitis eosinofílica: esófago en “papel crepé”.
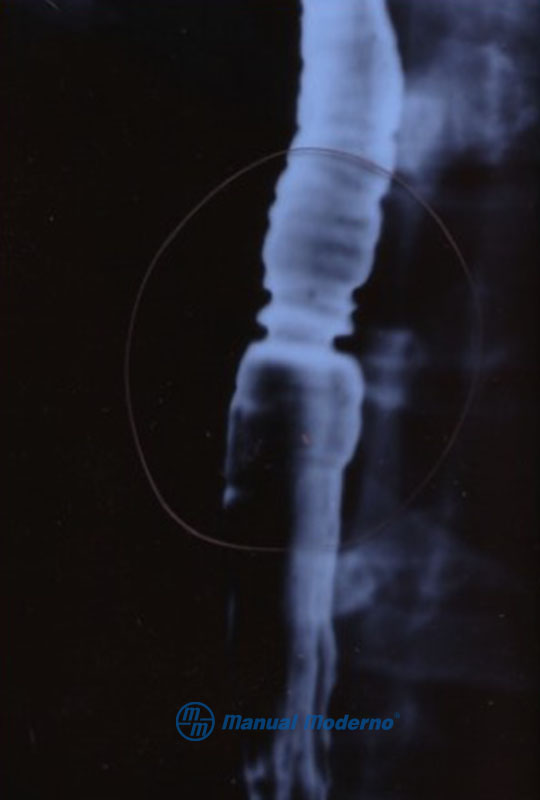
Figura 1.5.6D. Esofagograma baritado en esofagitis eosinofílica: anillos concéntricos y estenosis del esófago (traquealización).
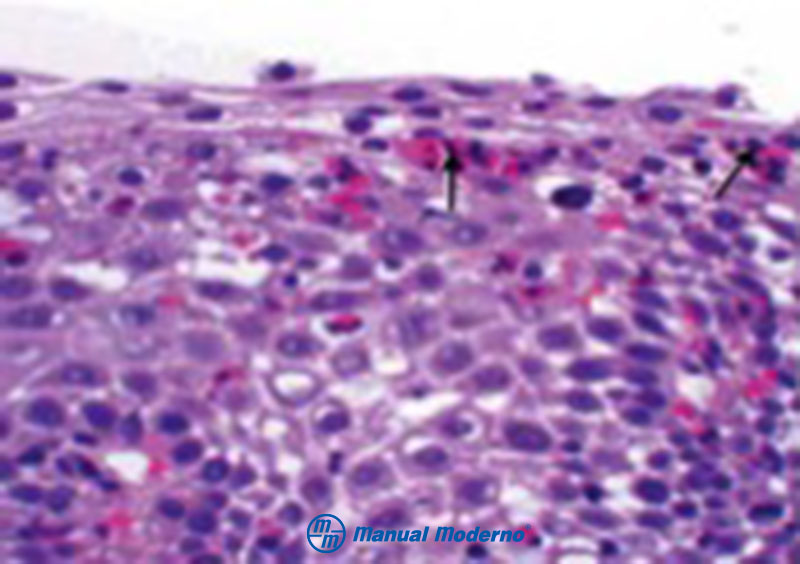
Figura 1.5.7A. Epitelio escamoso de la mucosa esofágica que muestra infi ltración de eosinófi los en la esofagitis eosinofílica.
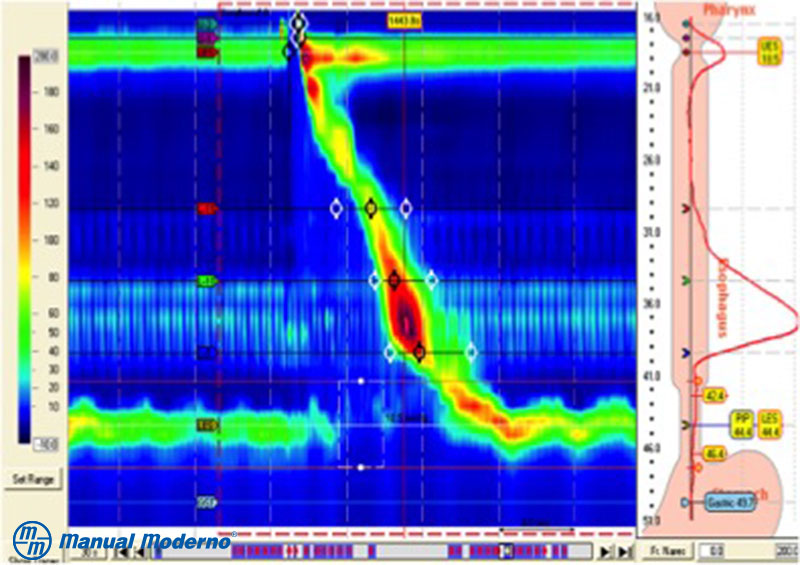
Figura 1.6.6A. Trazo de manometría esofágica de alta resolución que muestra una función motora normal (cortesía del Dr. Miguel Ángel Valdovinos Díaz).
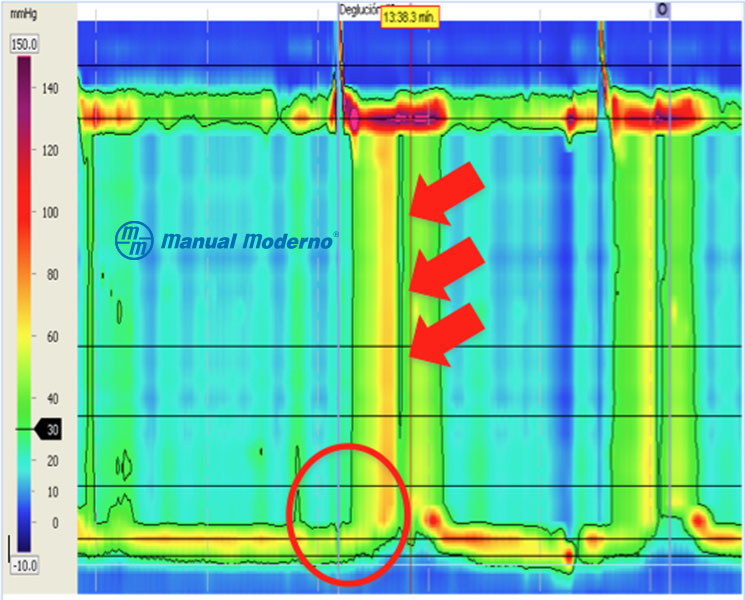
Figura 1.6.6B. Trazo de manometría esofágica de alta resolución correspondiente a acalasia tipo II. Las flechas muestran la aperistalsis del cuerpo esofágico con presurización panesofágica. En el círculo se muestra el esfínter esofágico inferior con presión de relajación integrada por arriba del límite normal con la falla en la relajación en respuesta a la deglución (cortesía del Dr. Miguel Ángel Valdovinos Díaz).
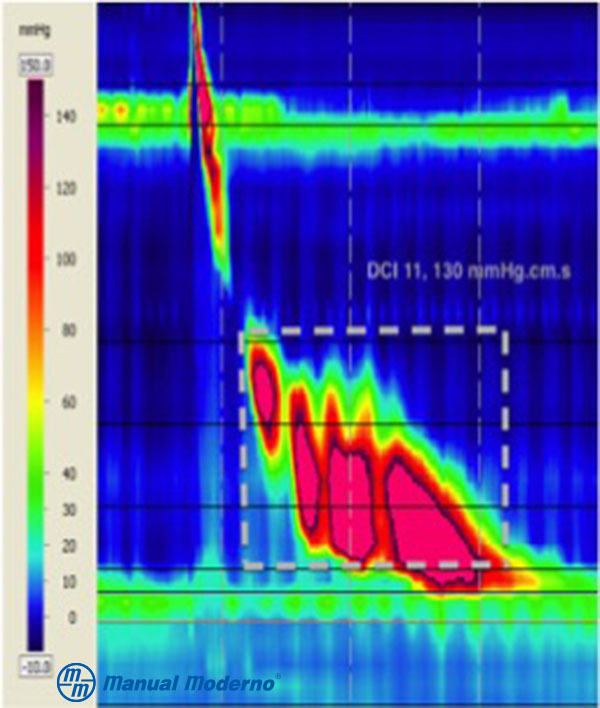
Figura 1.6.6C. Trazo de manometría esofágica de alta resolución correspondiente a esófago hipercontráctil (en martillo neumático). El trastorno se caracteriza por presión de relajación integrada normal y por lo menos dos degluciones con contractilidad distal integrada > 8 000 mm Hg/cm/seg (cortesía del Dr. Miguel Ángel Valdovinos Díaz).
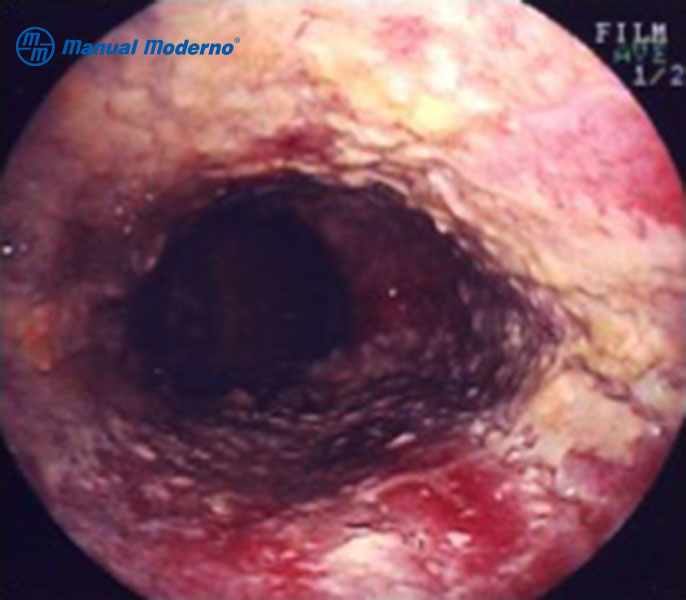
Figura 1.6.6D. Aspecto endoscópico de la acalasia.
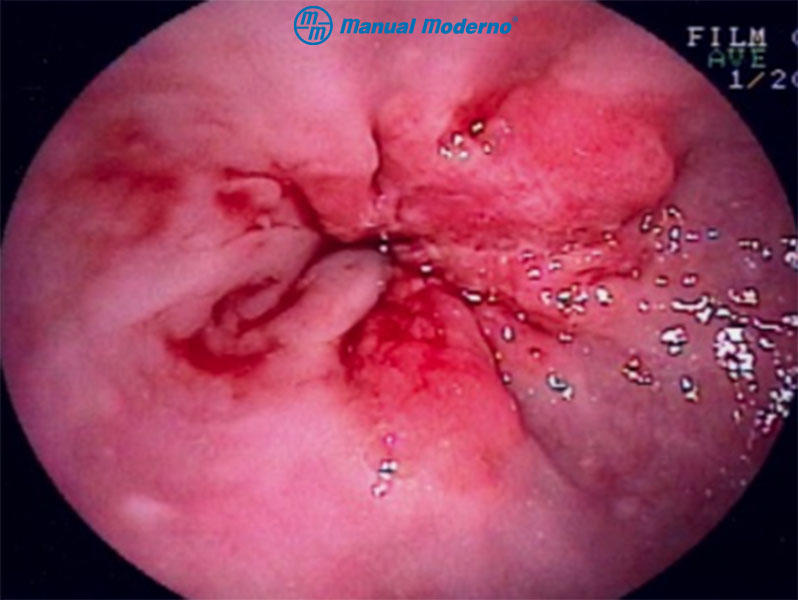
Figura 1.6.6E. Pseudoacalasia por neoplasia de la unión esofagogástrica.
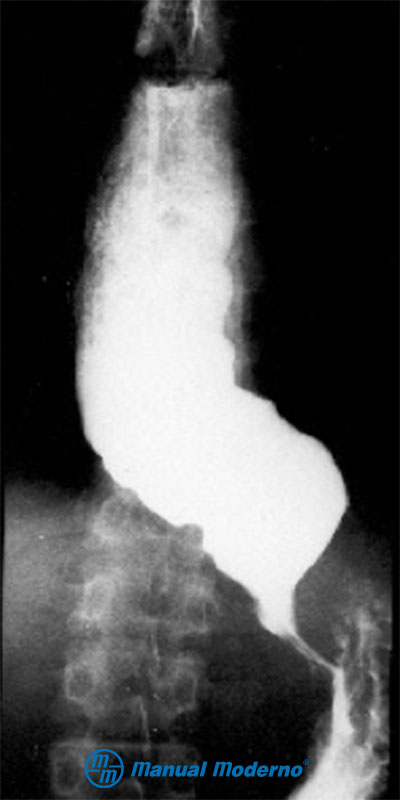
Figura 1.6.6F. Esofagograma de acalasia. Obsérvese la dilatación del esófago y la estenosis en “punta de lápiz” del cardias.
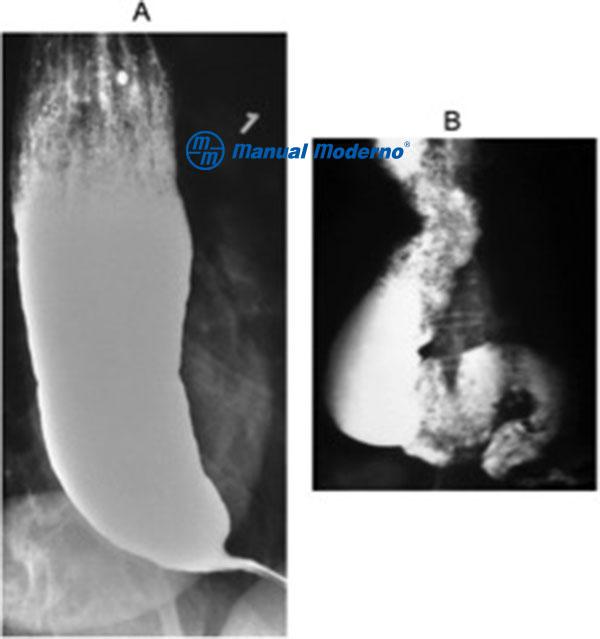
Figura 1.7.6A. A. Imagen típica de acalasia con un esófago dilatado y terminación de la unión esofagogástrica en pico de pájaro. B. Esófago sigmoideo en etapas avanzadas del padecimiento.
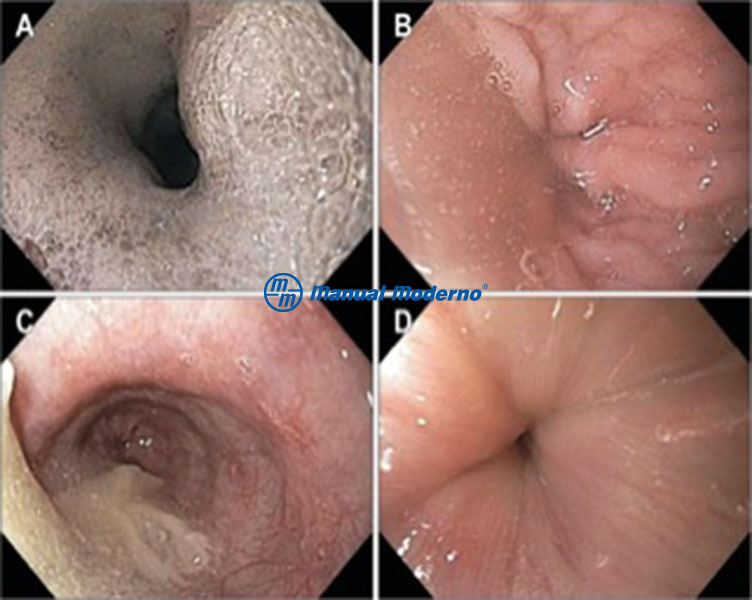
Figura 1.7.6B. Hallazgos endoscópicos en la acalasia. A. Retención de saliva. B y D. Unión esofagogástrica hipertensa/contraída a pesar de la insuflación con aire. C. Esófago dilatado con restos alimenticios.
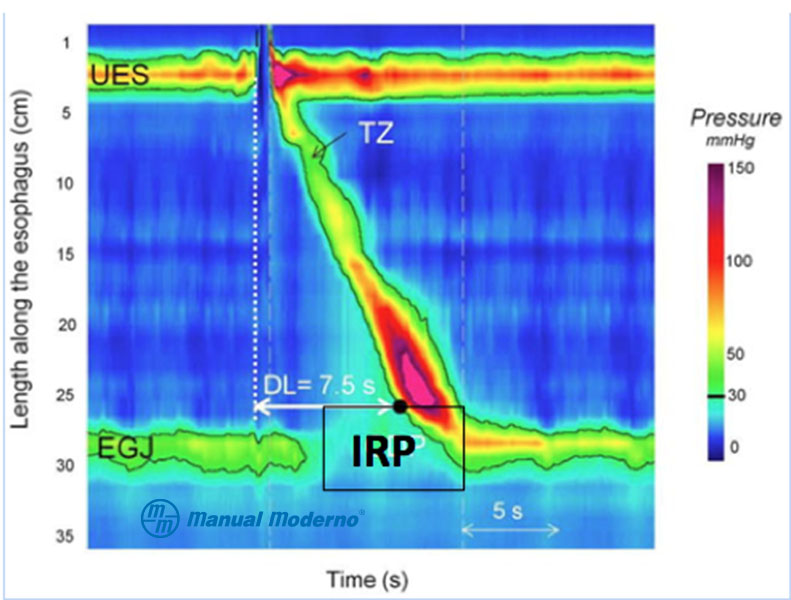
Figura 1.7.8A. A) Manometría normal con alta resolución.
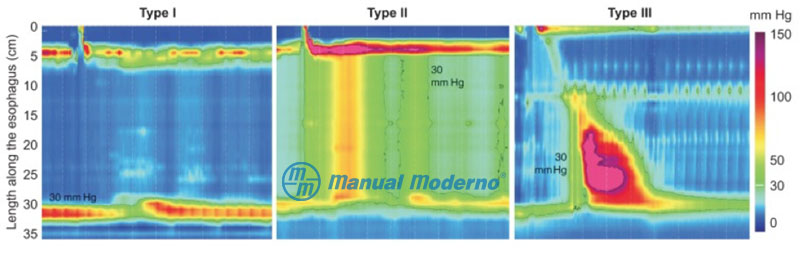
Figura 1.7.8A. B) Acalasia: tres tipos de acalasia identificados con manometría de alta resolución.
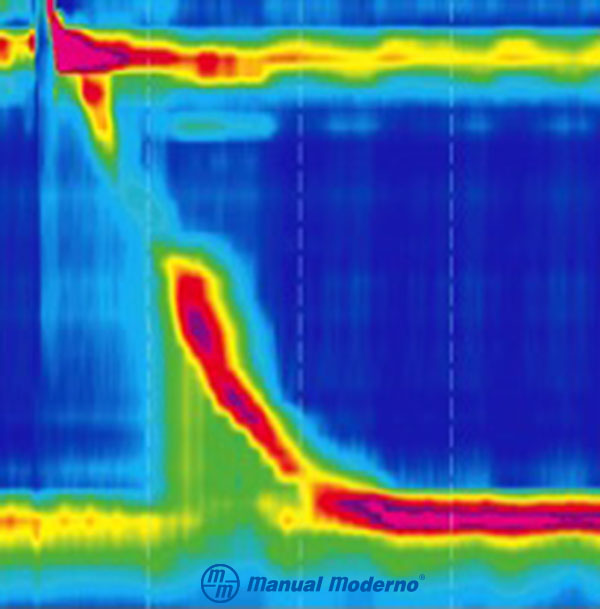
Figura 1.7.8A. C) Obstrucción del tracto de salida.
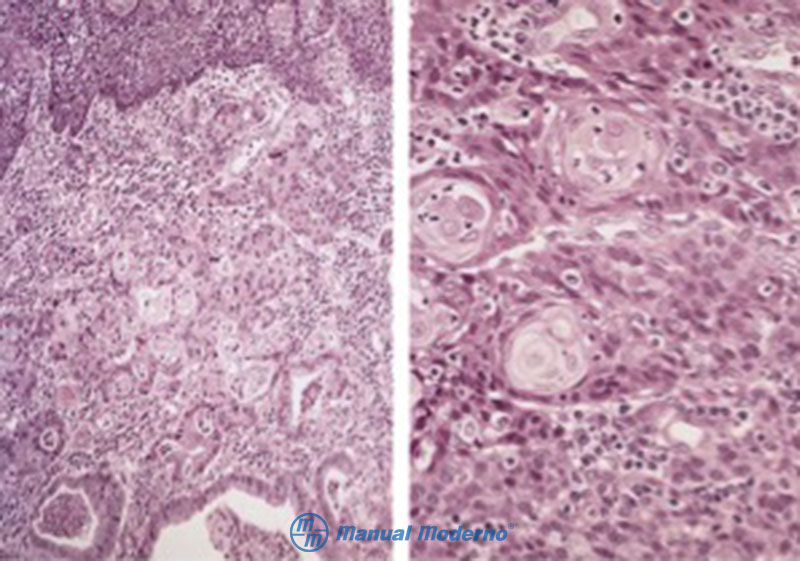
Figura 1.8.3A. Cortes histológicos de un carcinoma escamoso de esófago con tinción de hematoxilina y eosina. Izquierda, acercamiento de la mucosa y submucosa que demuestra una superficie de células escamosas con displasia subyacente de un carcinoma de células escamosas. Derecha, carcinoma de células escamosas queratinizante.
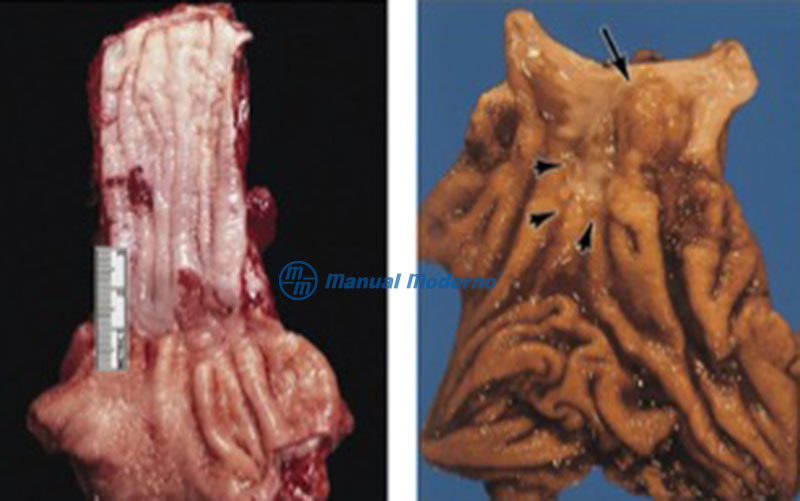
Figura 1.8.3B. Apariencia macroscópica de un adenocarcinoma esofágico en el esófago de Barrett. Izquierda, adenocarcinoma pequeño marcado por placas de color rosa justo por arriba de la unión gastroesofágica. Derecha, carcinoma en el segmento corto del esófago de Barrett, con infiltración a la mucosa gástrica.
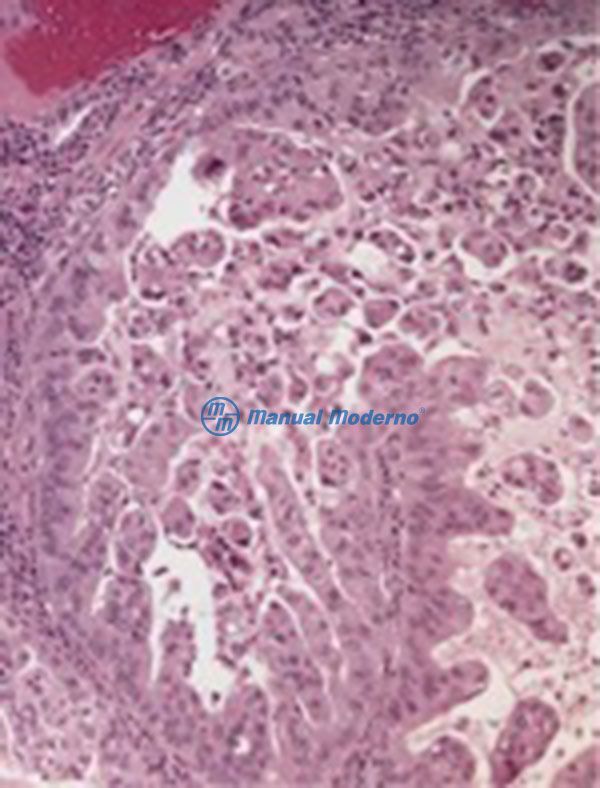
Figura 1.8.3C. Histopatología de un adenocarcinoma esofágico con tinción de hematoxilina eosina: adenocarcinoma esofágico bien diferenciado.
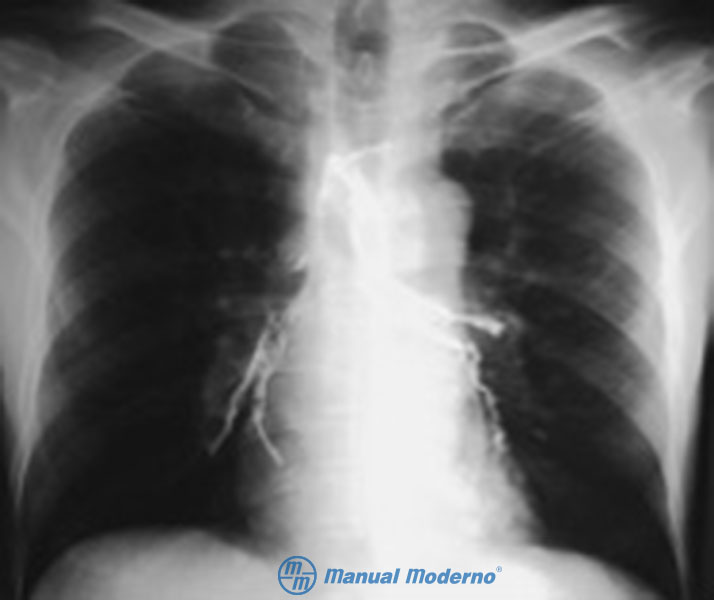
Figura 1.8.5A. Radiografía de tórax de un paciente sometido a un esofagograma con bario reciente. Se identifican la completa obstrucción del esófago y una fístula traqueoesofágica (nótese la presencia de bario en la vía aérea).
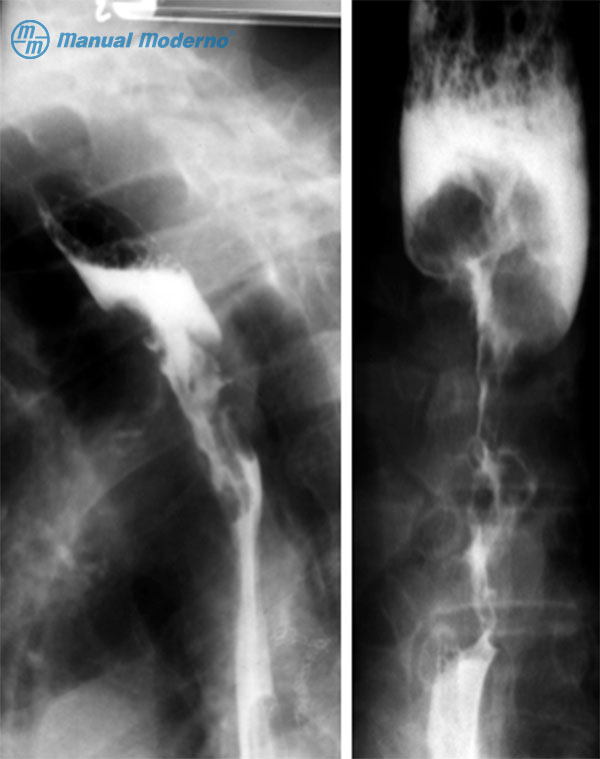
Figura 1.8.5B. Imágenes de esofagogramas de pacientes con cáncer epidermoide del esófago. En la imagen izquierda se observa en el tercio medio una imagen proliferativa que estenosa la luz del esófago. En la imagen derecha existe una dilatación esofágica proximal y la estenosis es concéntrica, lo que le confiere el aspecto de imagen en “mordida de manzana”.
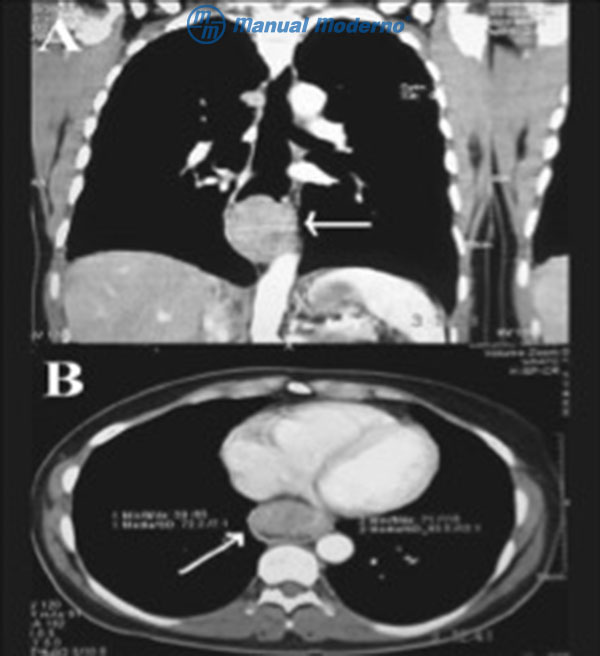
Figura 1.8.5C. Tomografía computarizada de tórax. A, corte coronal: se observa una lesión polipoide en tercio distal esofágico (flecha blanca). B, corte transversal: se reconoce una lesión polipoide que compromete toda la luz de esófago distal (flecha blanca).
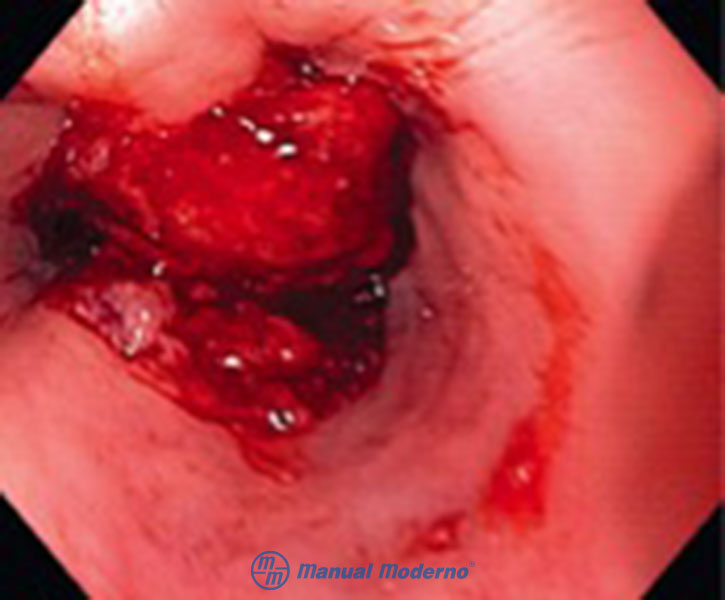
Figura 1.8.6A. Imagen endoscópica de un carcinoma esofágico de células escamosas avanzado que prácticamente ocluye la luz del esófago.
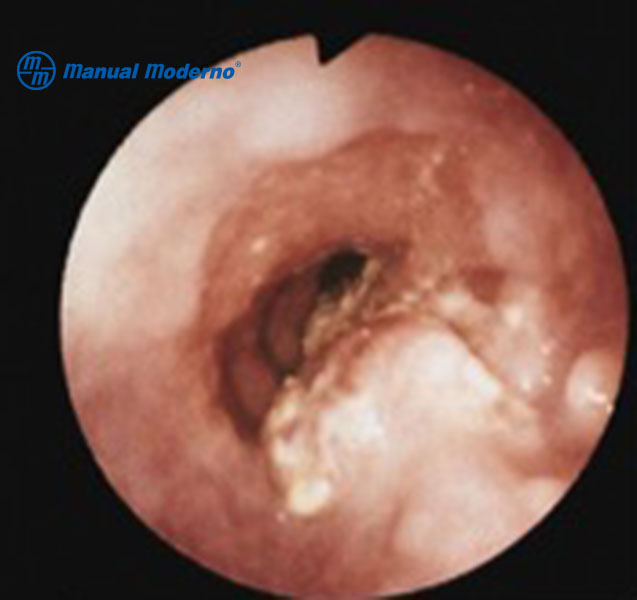
Figura 1.8.6B. Imagen endoscópica de un adenocarcinoma de esófago de tipo placa nodular sobre un esófago de Barrett.
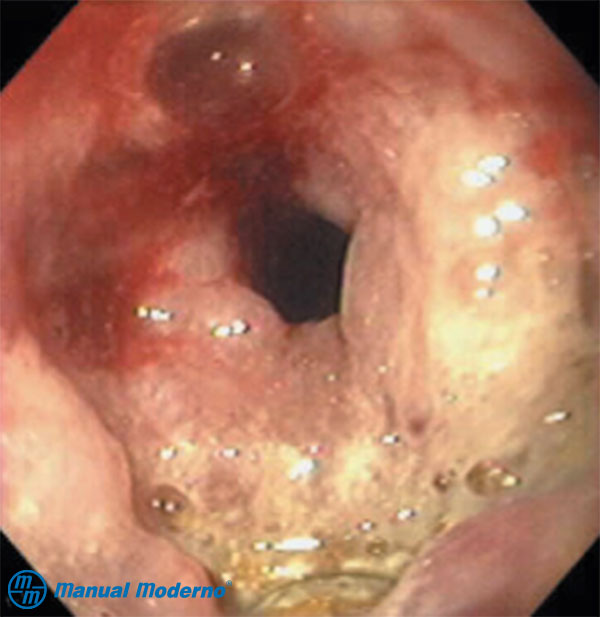
Figura 1.8.9.2A. Carcinoma circunferencial de esófago con desarrollo de fístula esofagomediastínica.

Figura 1.8.9.2B. Prótesis metálica cubierta autoexpandible en el plano esofágico.
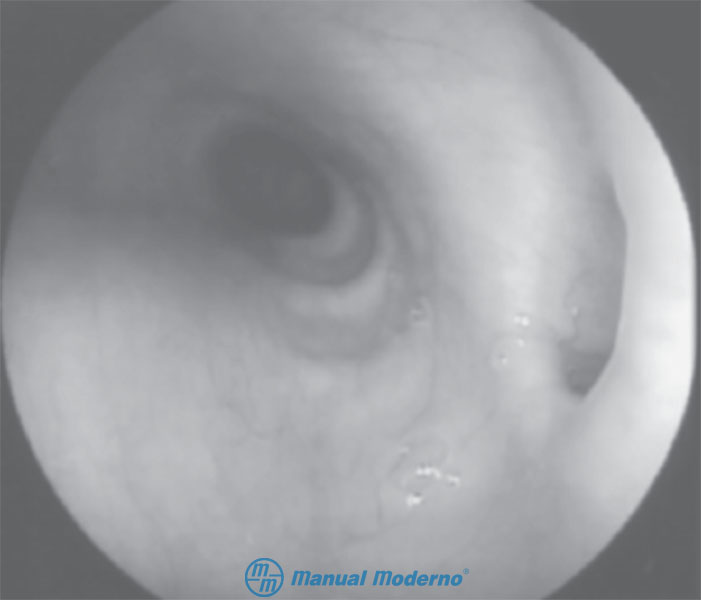
Figura 1.10.3A. Imagen endoscópica de un divertículo del tercio medio.
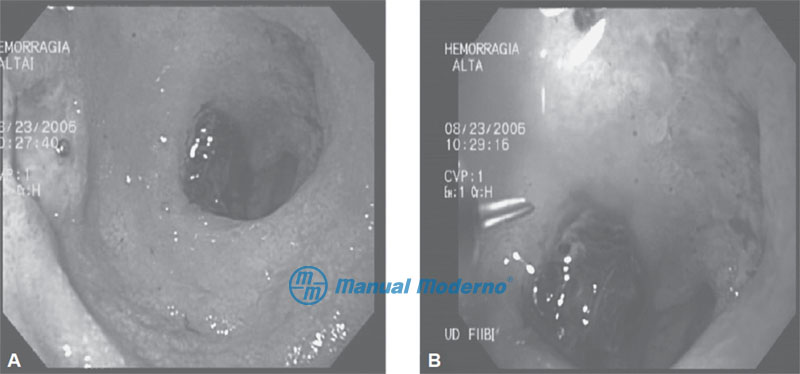
Figura 2.9.2AB. A. Úlcera duodenal y úlcera con coágulo adherido. B. Escleroterapia endoscópica en úlcera duodenal hemorrágica.
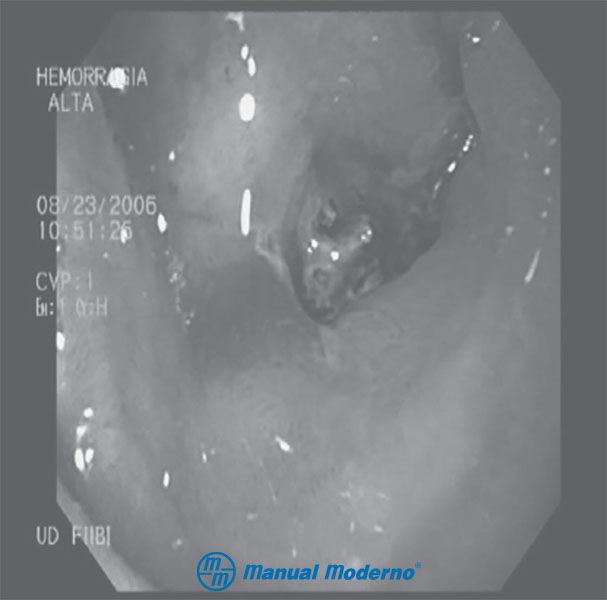
Figura 2.9.3B. Úlcera postratamiento con sonda de calor.
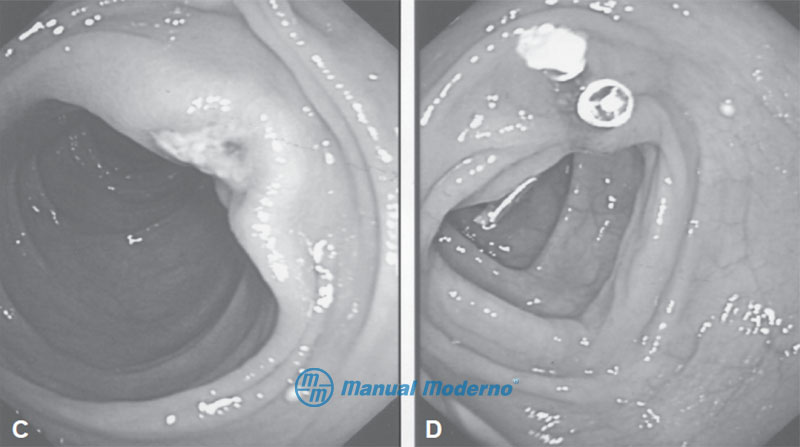
Figura 2.9.3CD. C. Úlcera con vaso visible en duodeno. D. Broche hemostático colocado sobre un vaso visible en una úlcera duodenal.
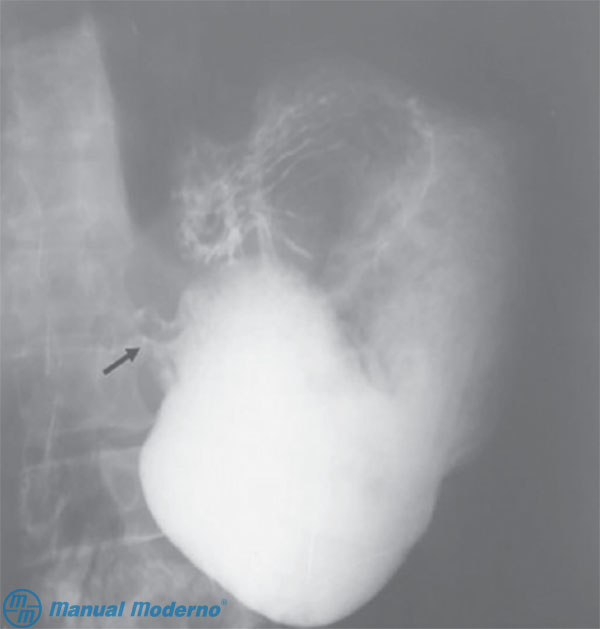
Figura 2.9.6A. Serie gastroduodenal que muestra el estómago dilatado con ausencia de paso del medio de contraste al duodeno debido a estenosis pilórica (flecha) de origen péptico.
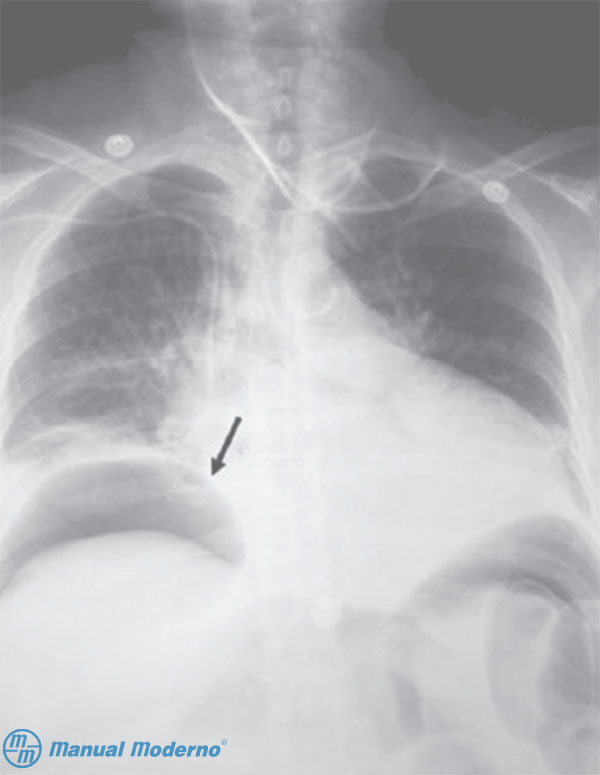
Figura 2.9.8A. Radiografía de tórax que muestra aire en áreas subdiafragmáticas (signo de la gaviota) en un paciente con perforación libre de úlcera duodenal.
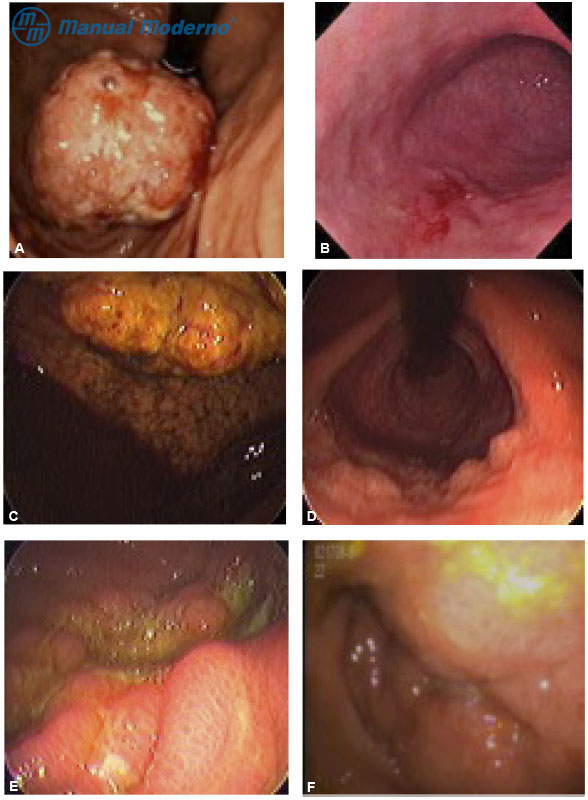
Figura 2.10.6A a F. A) Tumoración del fondo gástrico. B) Mucosa del cuerpo gástrico con patrón infiltrativo. C) Tumoración exofítica del cuerpo gástrico. D) Linitis plástica del cuerpo gástrico. E) Tumoración gástrica ulcerada. F) Antro gástrico con obstrucción pilórica secundaria a infiltración submucosa.
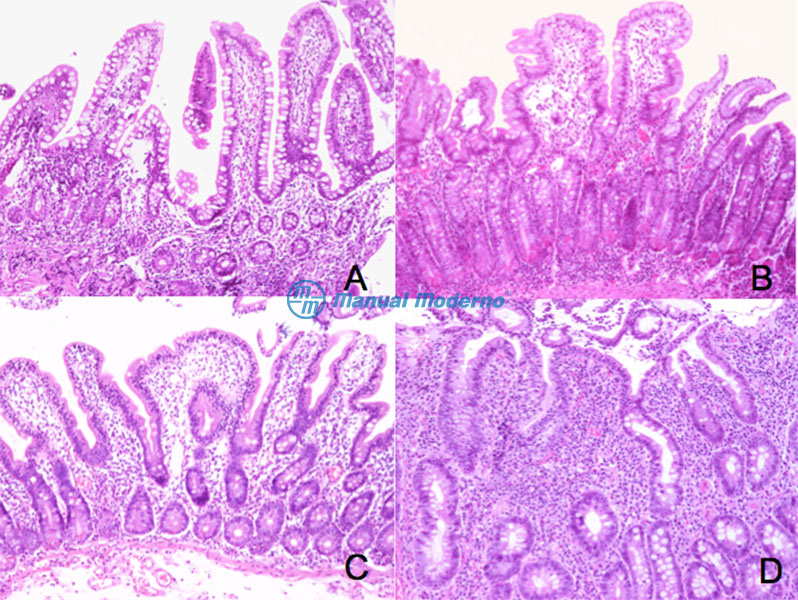
Figura 3.4.8A. Clasificación histológica de Marsh de la EC. Se presentan biopsias de duodeno de diferentes pacientes con EC. A) lesión de tipo 1 o infiltrativa; B) lesión de tipo 2 o hiperplásica; C) lesión de tipo 3 o destructiva; y D) lesión de tipo 4 o atrófica.
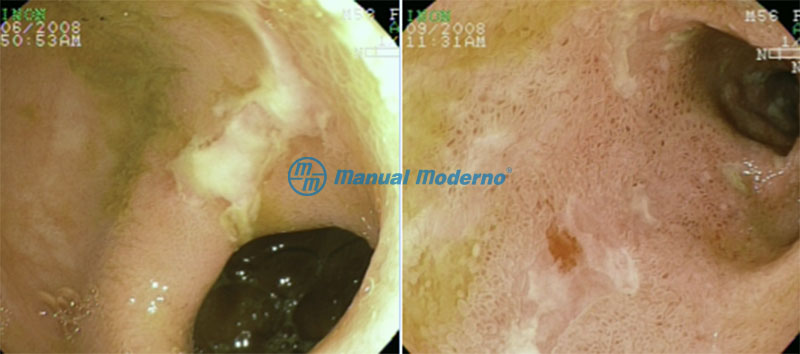
Figura 3.5.4A. Aspecto endoscópico de un paciente con enfermedad de Crohn; puede identificarse una úlcera serpiginosa de base blanca en el íleon terminal.
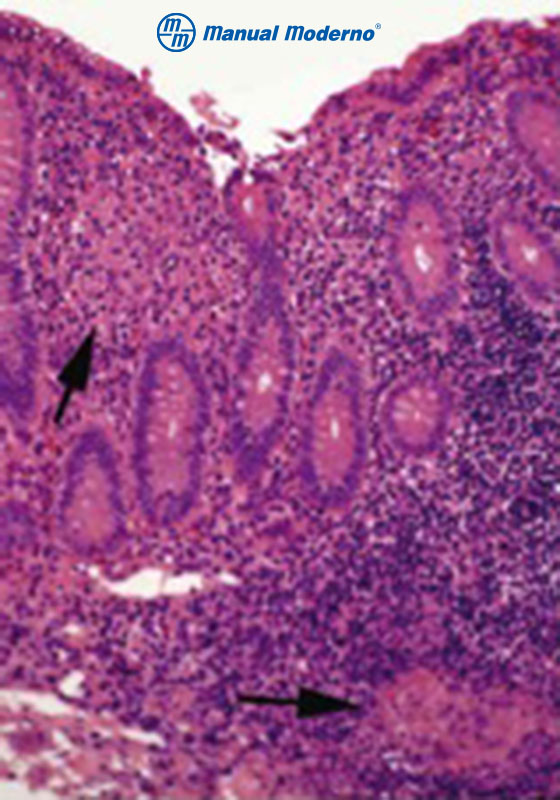
Figura 3.5.5A. Colitis por enfermedad de Crohn. Se observan dos granulomas no caseificantes dentro de la lámina propia.
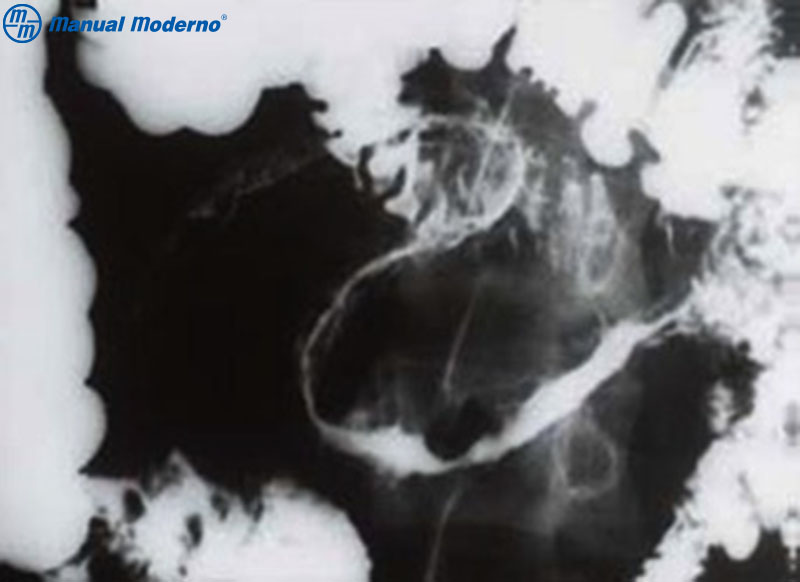
Figura 3.5.6A. Tránsito intestinal de un paciente con enfermedad de Crohn que muestra en el íleon terminal el típico “signo de la cuerda”.
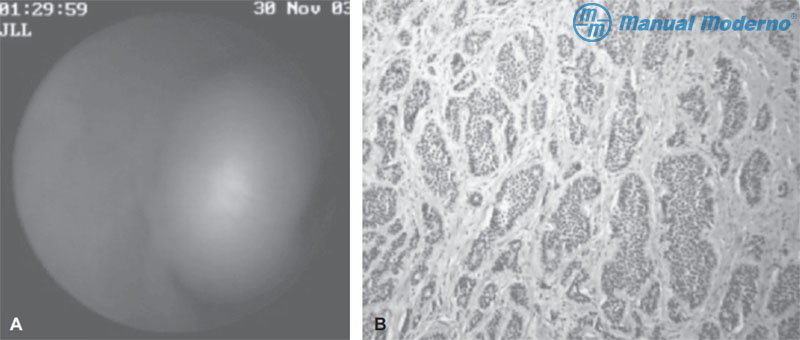
Figura 3.6.4AB. A) Imagen de un tumor carcinoide en íleon por cápsula endoscópica. Obsérvese la tumoración polipoidea pediculada. B) Imagen microscópica de un tumor carcinoide con tinción de H y E; se identifican células de tipo epitelial que infiltran la capa muscular en forma de acumulación y producen un patrón insular típico.
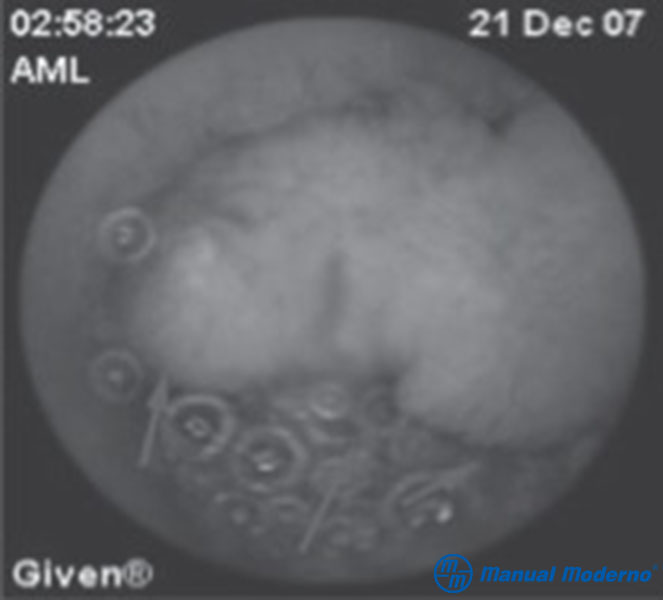
Figura 3.6.6A. Pólipo hamartomatoso observado mediante cápsula endoscópica en yeyuno en un paciente de 13 años de edad con síndrome de Peutz-Jeghers.
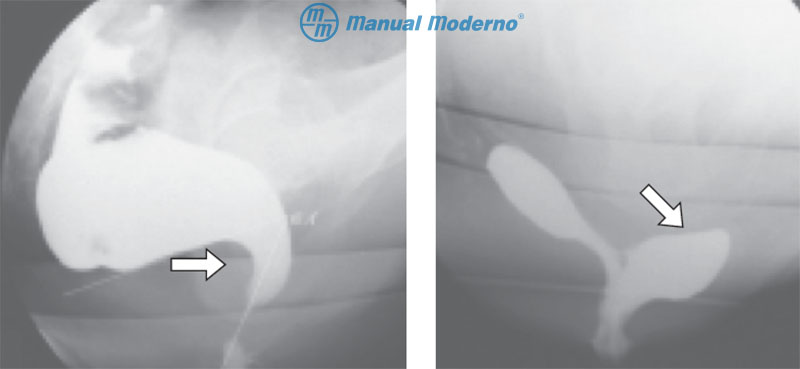
Figura 4.3.10A. Defecografía dinámica. Izquierda, anismo expresado mediante cierre del ángulo puborrectal durante la defecación (flecha). Derecha, imagen de un rectocele anterior (flecha).
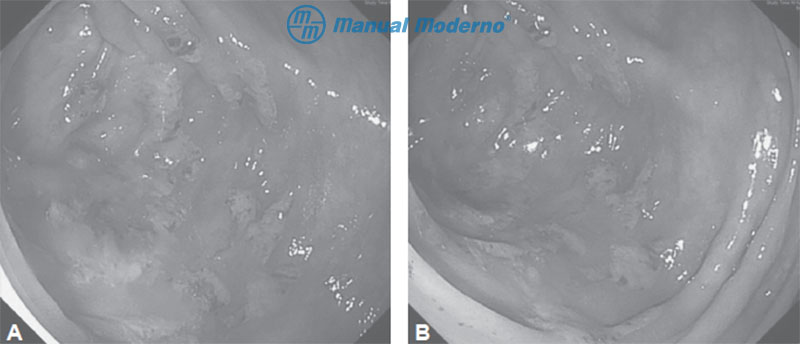
Figura 4.4.6A y B. Aspecto endoscópico de una colitis por ameba. Se observa engrosamiento de la mucosa con ulceraciones puntiformes, exudado y edema.
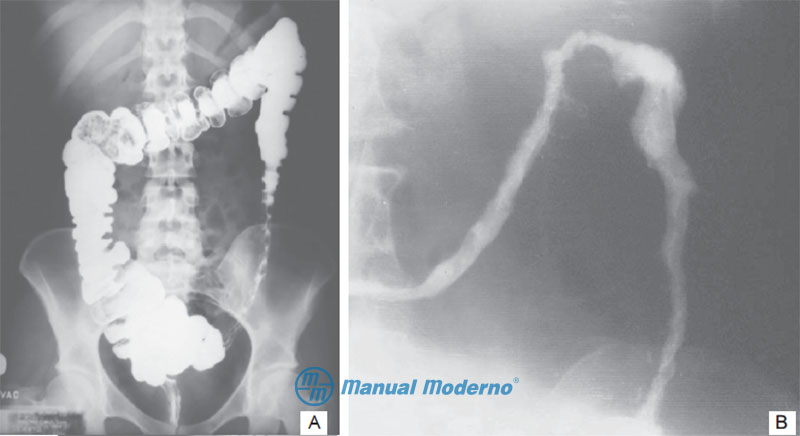
Figura 4.5.4A. Colon por enema en la colitis isquémica. A) Se observa el signo de “impresiones digitales” debido a nódulos submucosos en fase aguda. B) Se reconoce una estrechez de la luz y pérdida del contorno normal del colon en colitis crónica.
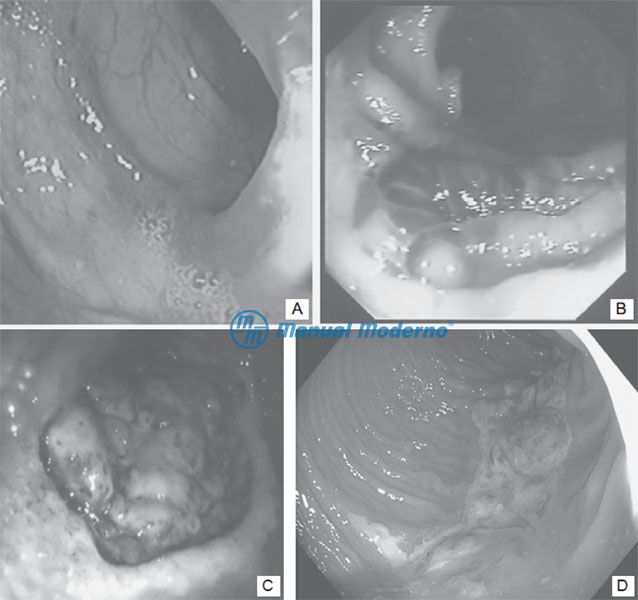
Figura 4.5.5AD. A) Edema e hiperemia en la forma leve. B) Hemorragias submucosas. C) Nódulos violáceos. D) Ulceración segmentaria.
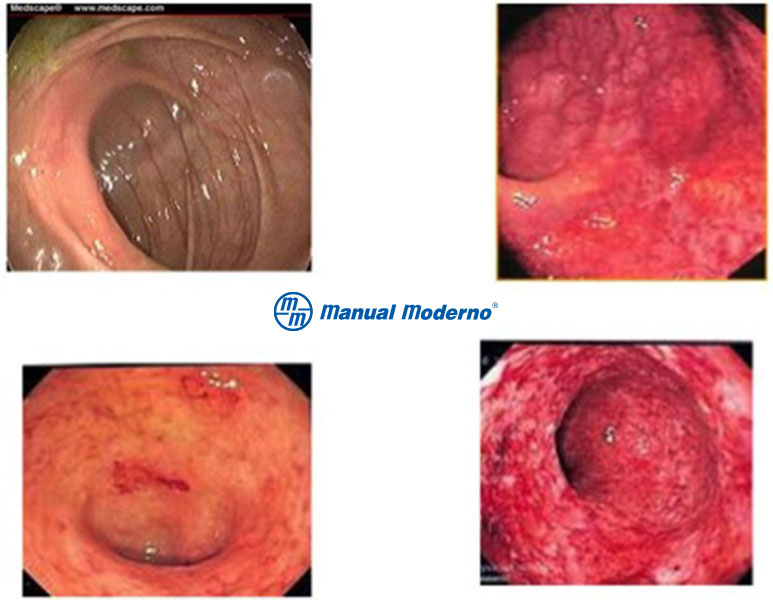
Figura 4.6.4A. Aspecto endoscópico de la colitis ulcerosa crónica idiopática en diferentes estadios. A) Enfermedad inactiva. B) Actividad leve: eritema difuso con aumento del patrón vascular. C) Actividad moderada: eritema, granularidad y erosiones o úlceras no confluentes. D) Actividad grave: mucosa muy inflamada, edema, friabilidad tisular, úlceras sangrantes confluentes. Puntuación de Mayo endoscópica.
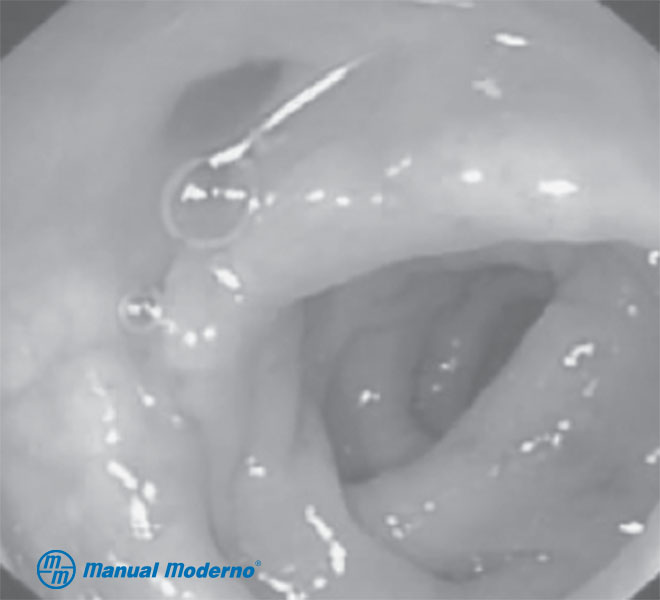
Figura 4.7.7A. Imagen endoscópica del colon sigmoides con divertículos.
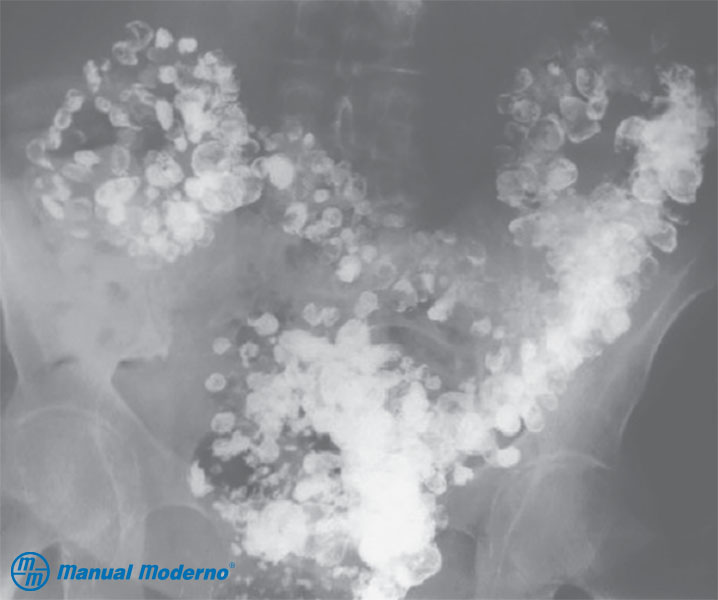
Figura 4.7.7B. Colon por enema que muestra imágenes características de divertículos.
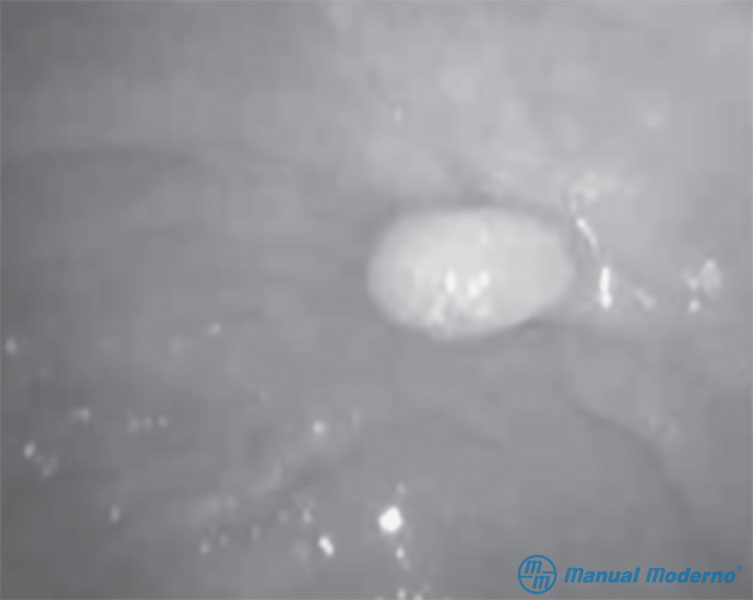
Figura 4.8.8A. Aspecto de un pólipo identificado por colonoscopia.
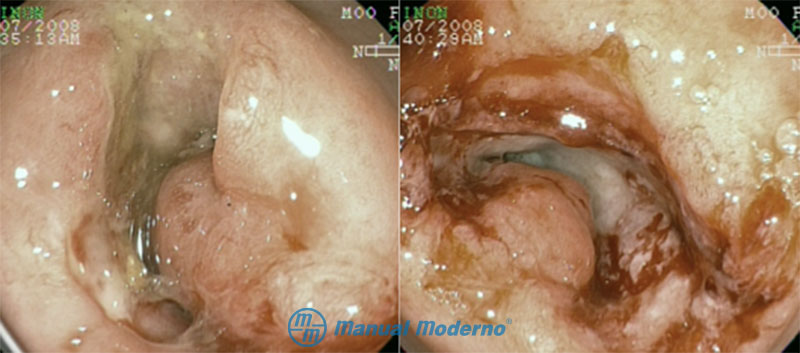
Figura 4.9.5A. Aspecto endoscópico del cáncer de colon; puede observarse una tumoración exofítica ulcerada de fisonomía polipoidea en el sigmoides.
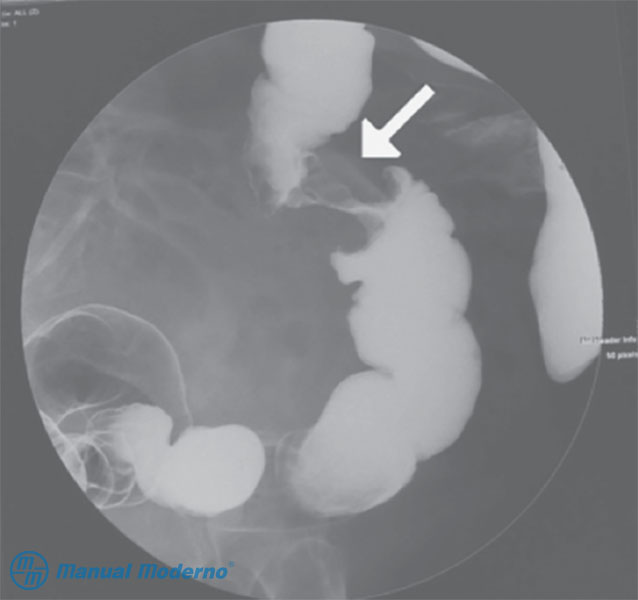
Figura 4.9.5B. Imagen radiológica de un cáncer de colon delineado mediante enema baritado con doble contraste. Obsérvese una lesión circunferencial que produce estenosis de la luz del colon y crea el aspecto conocido como “manzana mordida”.
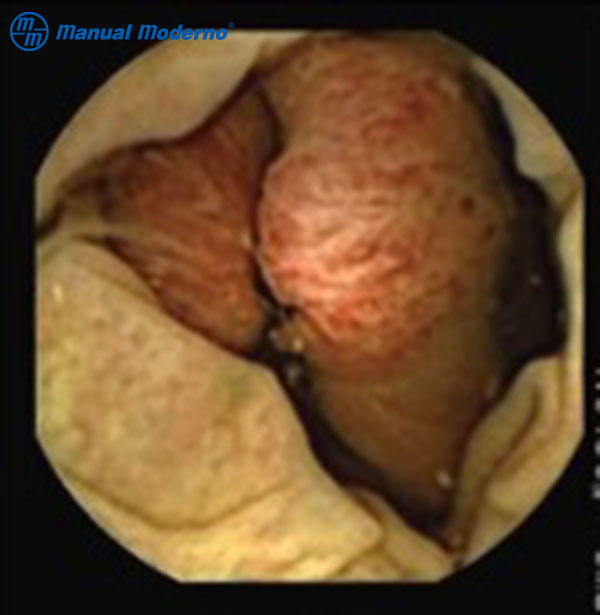
Figura 4.9.5C. Imagen de un adenocarcinoma en colon diagnosticado por cápsula endoscópica colónica.
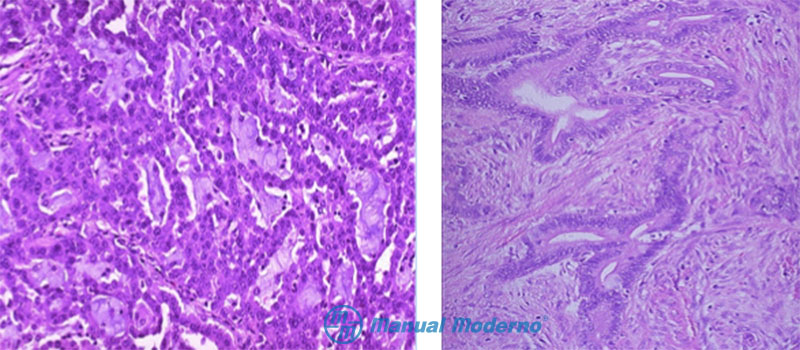
Figura 4.9.7A. Aspecto microscópico del adenocarcinoma de colon. En la figura de la izquierda el cáncer muestra diferenciación moderada. Obsérvese la conservación de glándulas, aunque distorsionadas, y el contenido de mucina en algunas de ellas. En la figura de la derecha, el cáncer es indiferenciado. Nótense la pérdida de la estructura glandular, el grado de invasión en el estroma y la pérdida de la polaridad y uniformidad de las células epiteliales.
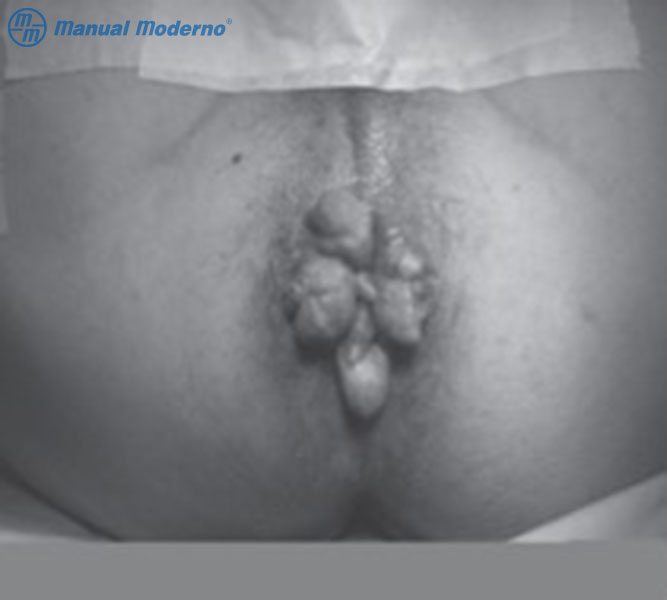
Figura 5.3.6A. Aspecto de una hemorroides de grado IV. Obsérvense los paquetes hemorroidales prolapsados de manera permanente del conducto anal.
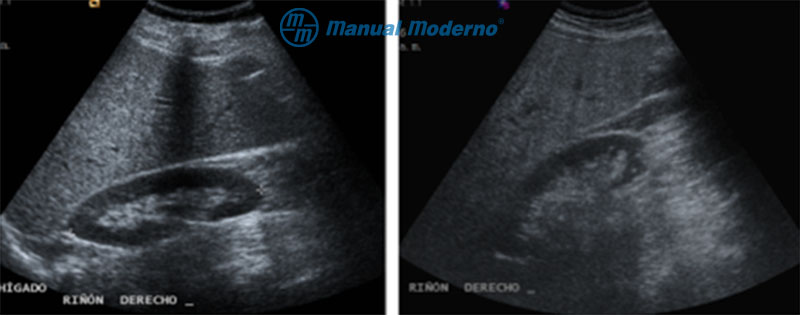
Figura 6.7.9A. Imagen ultrasonográfica de una esteatosis hepática.
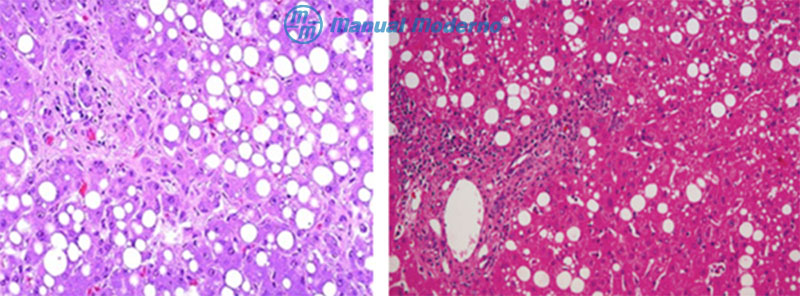
Figura 6.7.9B. Características histológicas de la EHGNA. A. Esteatosis simple. B. Esteatohepatitis.
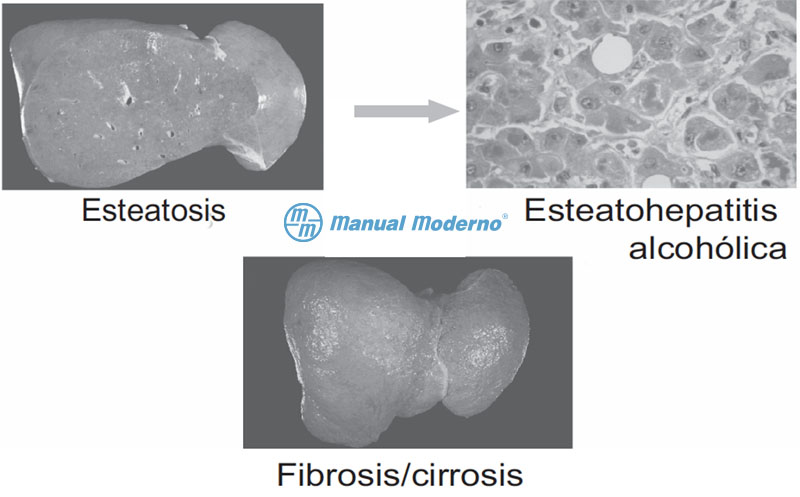
Figura 6.8.6A. Etapas de la lesión hepática por alcohol.
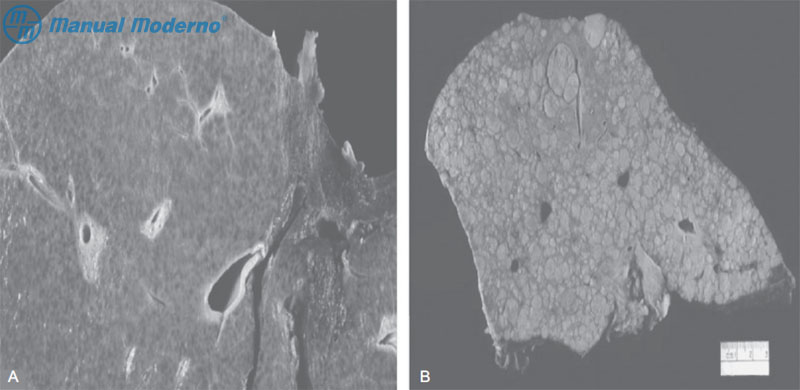
Figura 6.9.1A. A. Imagen macroscópica de hígado con cirrosis micronodular. B. Imagen macroscópica de hígado con cirrosis macronodular.
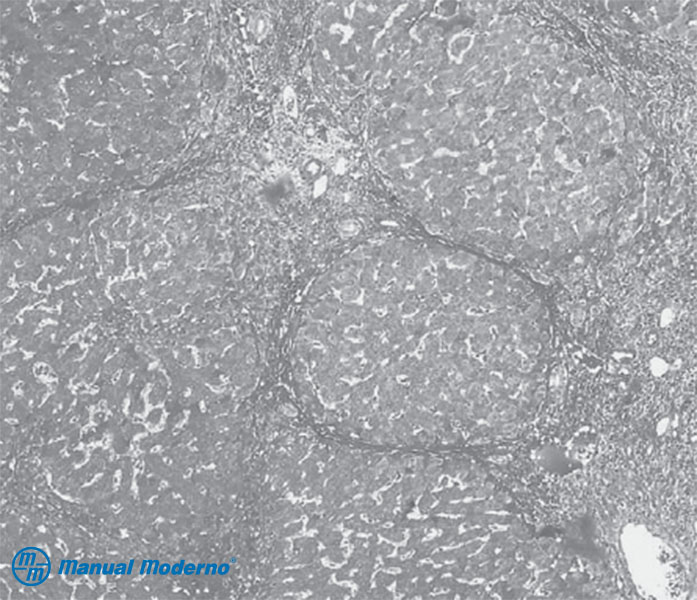
Figura 6.9.6A. Aspecto microscópico de la cirrosis hepática con tinción de tricrómico. Se observan los nódulos de regeneración rodeados por bandas de fibrosis y espacios porta. (Cortesía de la Dra. Sayuri Rivera. Departamento de Anatomía Patológica, Hospital Universitario, UANL).
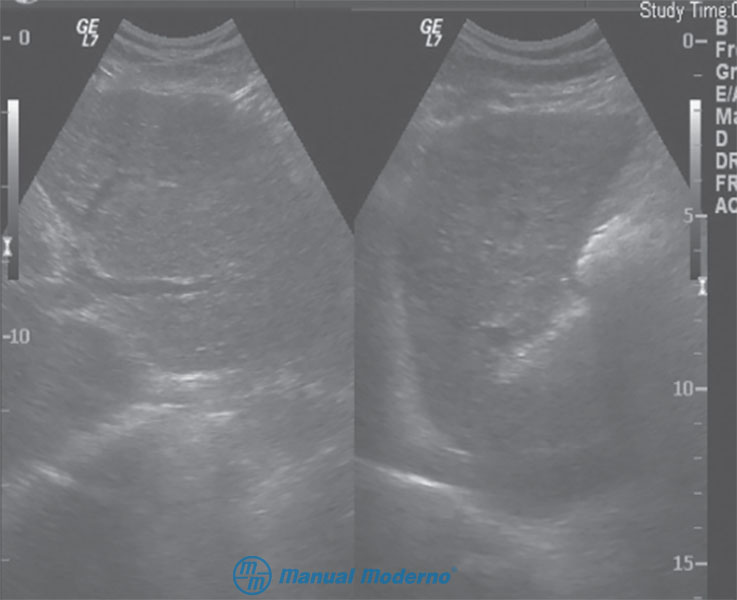
Figura 6.9.6B. Ultrasonido de un paciente con cirrosis hepática en el que se observa una glándula hepática atrófica de superficie irregular, así como signos de hipertensión portal como aumento del diámetro de la vena porta y ascitis. (Cortesía del Centro Universitario de Imagen Diagnóstica, Hospital Universitario, UANL).
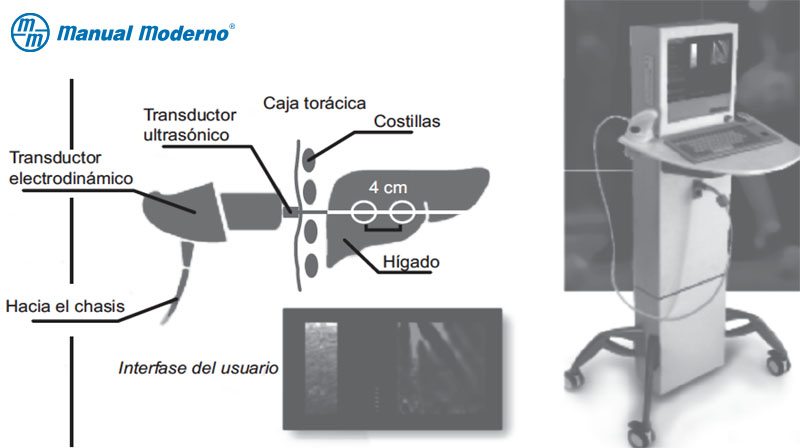
Figura 6.9.6C. Instrumento utilizado y principio del procedimiento conocido como elastografía que determina el grado de fibrosis hepática.
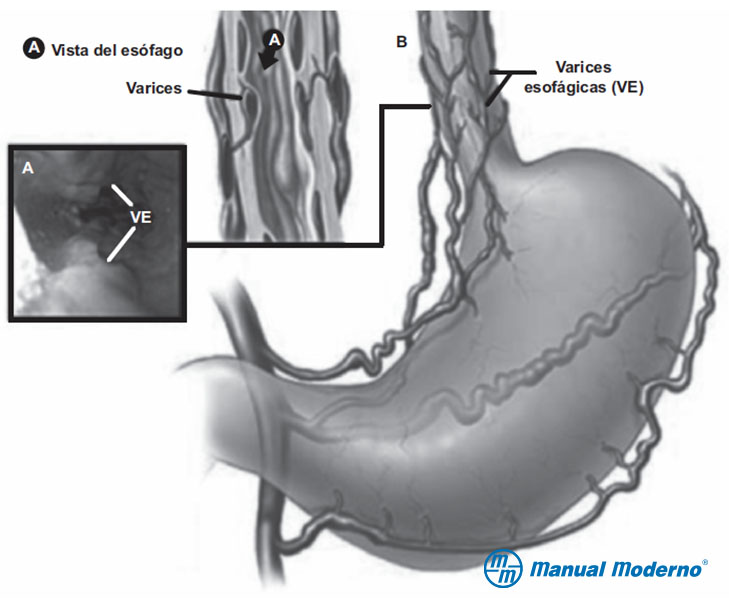
Figura 6.9.7B. Irrigación venosa del estómago para mostrar la formación de várices esofágicas (VE) a partir de las venas gástricas izquierda y derecha que bordean la curvatura menor.
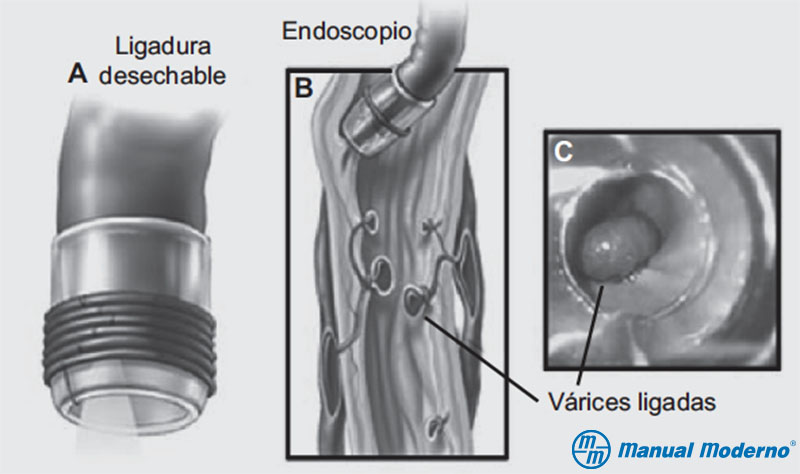
Figura 6.9.7F. Ligadura de várices esofágicas.
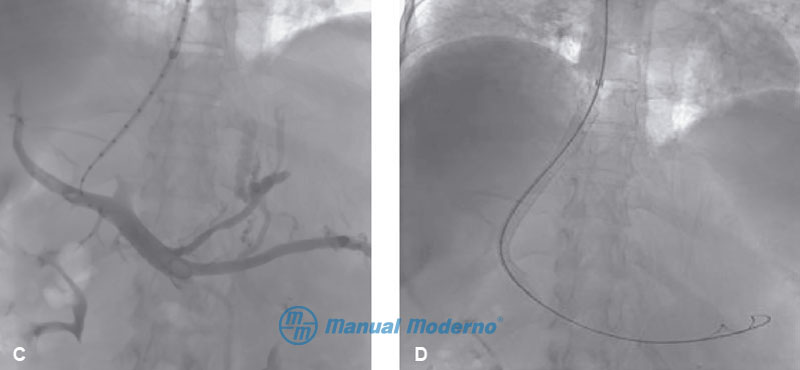
Figura 6.11.11C y D. C) Punción de la rama derecha de la vena porta intrahepática; se observan el tronco de la porta, las venas esplénicas y colaterales esofágicas. D) Se observa la prótesis metálica que comunica a la vena porta con la vena cava inferior por debajo de la aurícula derecha.
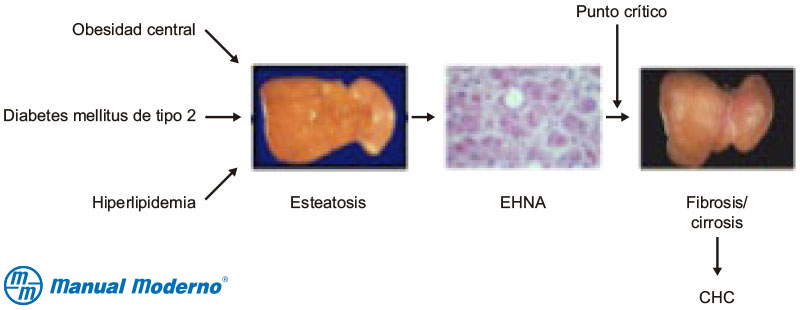
Figura 6.14.1A. Secuencia de los sucesos que ocurren en la enfermedad hepática grasa no alcohólica (EHGNA) causada por la diabetes mellitus y el síndrome metabólico y que tienen como resultado la formación de cirrosis. EHNA, esteatohepatitis no alcohólica; CHC, carcinoma hepatocelular.
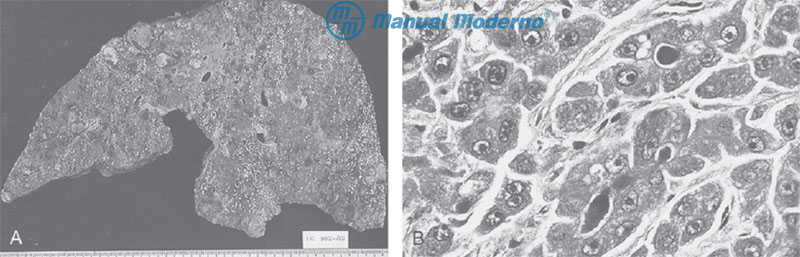
Figura 6.19.1A. A) Fotografía macroscópica de un hepatocarcinoma difuso. Se observan múltiples nódulos blanquecinos diseminados en ambos lóbulos. Se confunden con los nódulos de regeneración típicos de la cirrosis. B) Aspecto histopatológico del CHC moderadamente a bien diferenciado. Se observan trabéculas, seudoglándulas y acinos. Las células tienen núcleos hipercromáticos y pérdida de la polarización celular.
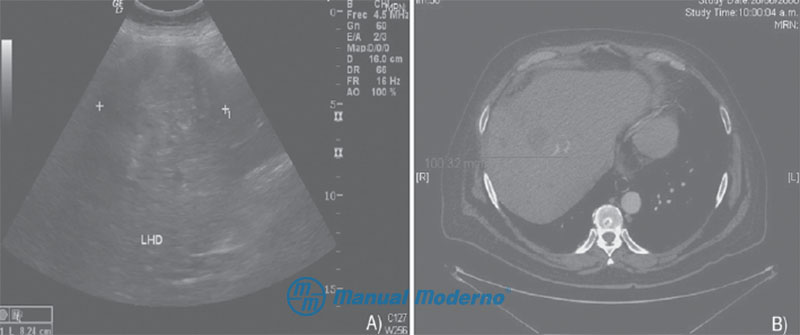
Figura 6.19.6A. A) Ultrasonido de abdomen superior de un paciente con hepatocarcinoma de gran tamaño en el lóbulo derecho. Obsérvese su centro hiperecogénico que refl eja hipervascularidad (cortesía del Centro Universitario de Imagen Diagnóstica, Hospital Universitario, UANL). B) TAC simple de un paciente con hepatocarcinoma. Obsérvese la tumoración pequeña en el lóbulo derecho (cortesía del Centro Universitario de Imagen Diagnóstica, Hospital Universitario, UANL).
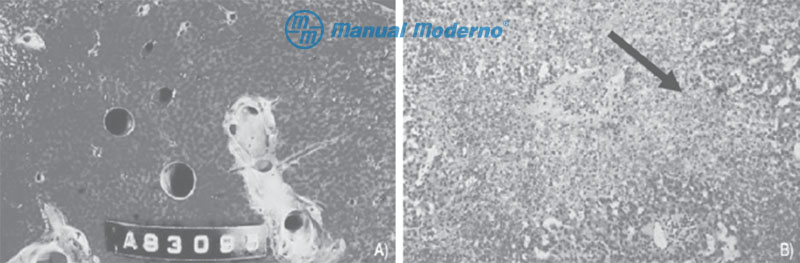
Figura 6.21.2AB. A) Imagen macroscópica característica de un hígado de estasis con aspecto en nuez moscada. B) Aspecto histológico de la congestión hepática. Obsérvese la dilatación de los sinusoides. La flecha indica dilatación de la vena centrolobulillar. Hay daño alrededor de la vena y no existe infiltrado inflamatorio.
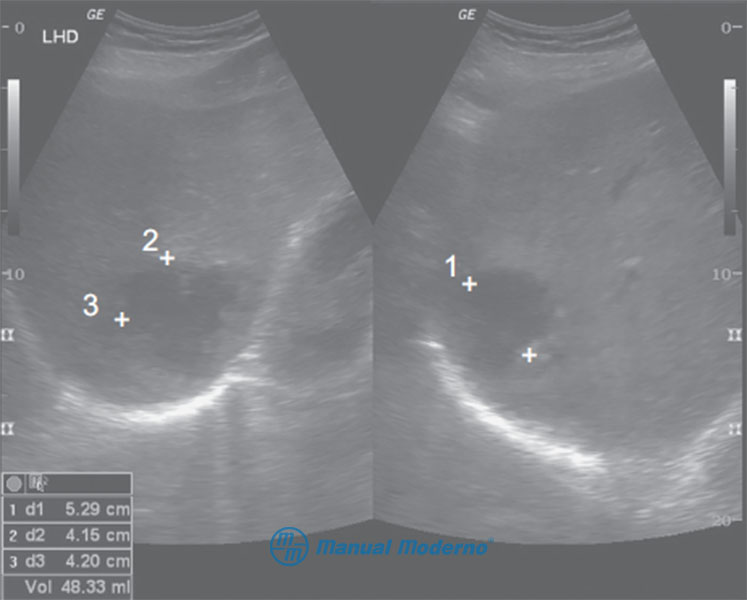
Figura 6.25.15A. Ultrasonido abdominal en el cual se muestra un absceso hepático amebiano en el lóbulo derecho. Se trata de una masa de gran tamaño con ecogenicidad heterogénea bien delimitada del parénquima normal (cortesía del Centro de Universitario de Imagen Diagnóstica, Hospital Universitario, UANL).
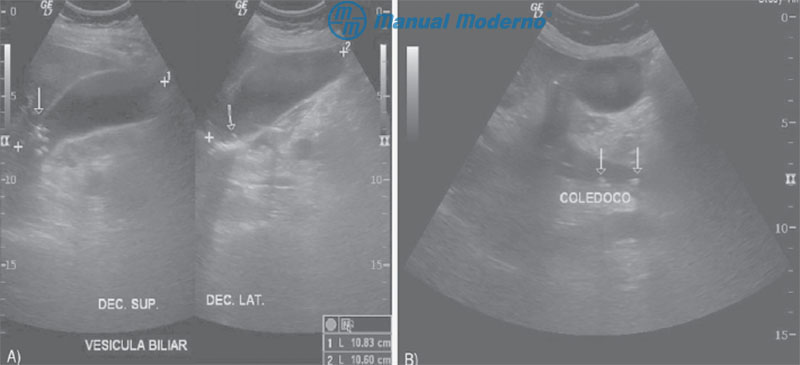
Figura 6.26.11A. A) Ultrasonido de abdomen superior en un paciente con colecitolitiasis. Obsérvese la presencia de varios litos hiperacústicos y el cono de sombra que reflejan. B) Ultrasonido abdominal de un paciente con coledocolitiasis. Nótense las concreciones en el interior del colédoco muy dilatado.
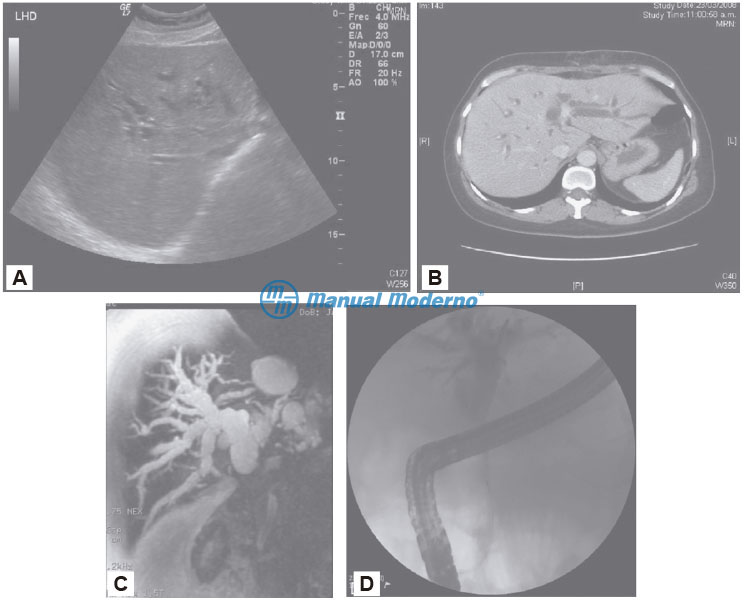
Figura 6.27.2A. A) Ultrasonido abdominal que muestra dilatación de las vías biliares intrahepáticas. Esta imagen es típica de una obstrucción de vías biliares extrahepáticas. El paciente tenía un carcinoma de vías biliares (cortesía del Centro Universitario de Imagen Diagnóstica, Hospital Universitario, UANL). B) TAC de abdomen que muestra hígado con dilatación de vías biliares intrahepáticas más intensa en sistema izquierdo, debido a un colangiocarcinoma intraductal en la confluencia hiliar (cortesía del Centro Universitario de Imagen Diagnóstica, Hospital Universitario, UANL). C) Colangiorresonancia de un paciente con colangiocarcinoma localizado en el hilio hepático. Obsérvese la reconstrucción digital de las vías biliares intrahepáticas que se identifican dilatadas con una amputación en el hilio (cortesía del Centro Universitario de Imagen Diagnóstica, Hospital Universitario, UANL). D) Colangiopancreatografía retrógrada endoscópica de un paciente con colangiocarcinoma en la que se muestra un segmento de estenosis en el colédoco con una zona de dilatación proximal y de vías biliares intrahepáticas (cortesía del Centro Universitario de Imagen Diagnóstica, UANL).
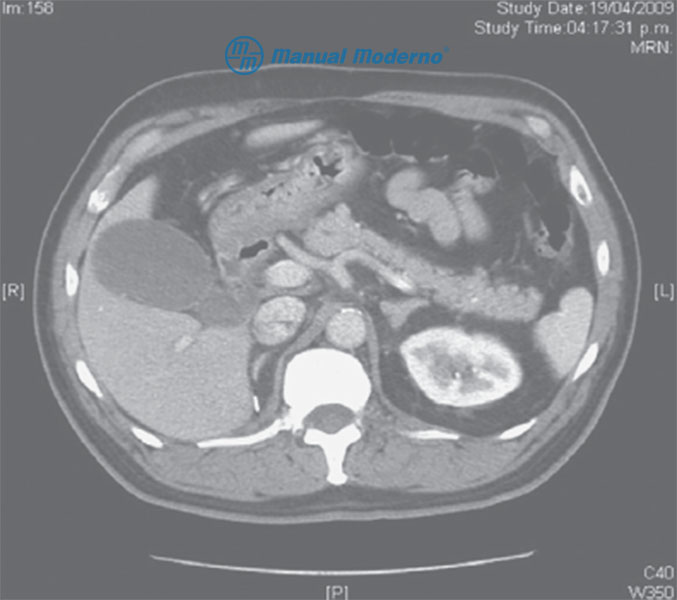
*Figura 7.2.8A. TAC abdominal de un paciente con pancreatitis crónica. Se observa un páncreas heterogéneo con contornos irregulares (cortesía del Centro Universitario de Imagen Diagnóstica, Hospital Universitario, UANL).
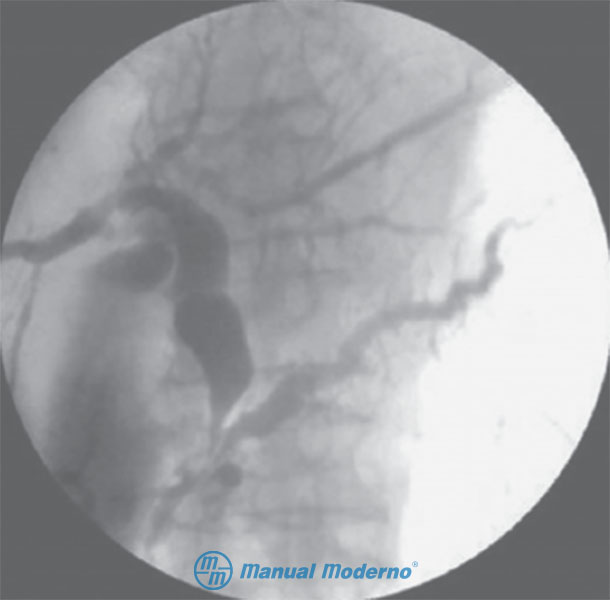
Figura 7.2.8B. CPRE de un paciente con pancreatitis crónica en etapa intermedia. Obsérvese el conducto pancreático algo dilatado de contorno irregular y reducción de las ramas colaterales (cortesía del Centro Universitario de Imagen Diagnóstica, Hospital Universitario, UANL).
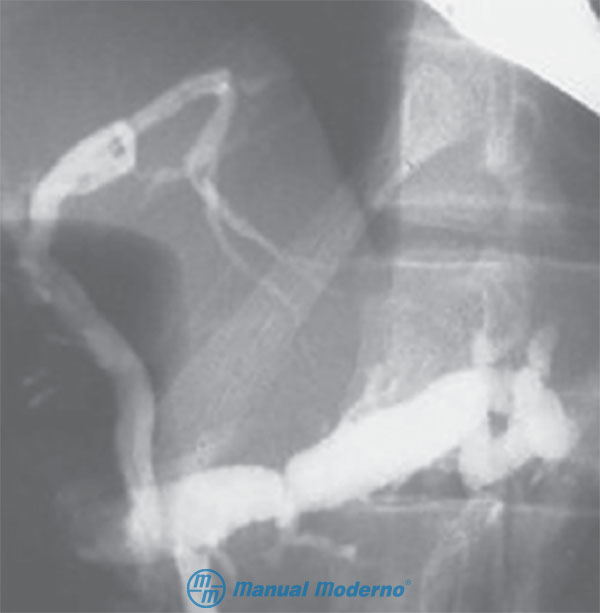
Figura 7.2.8C. CPRE de un paciente con pancreatitis crónica en etapa avanzada. Obsérvese la dilatación notable del conducto de Wirsung, la amputación de los conductos colaterales pancreáticos y los segmentos estenóticos (cortesía del Centro Universitario de Imagen Diagnóstica, Hospital Universitario, UANL).
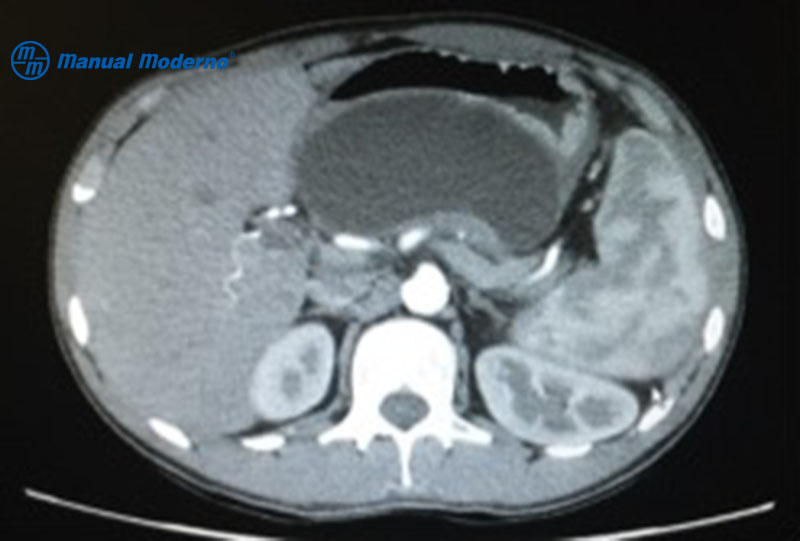
Figura 7.4.3A. Seudoquiste pancreático por tomografía computarizada abdominal localizado a nivel de la cabeza y cuerpo del páncreas.
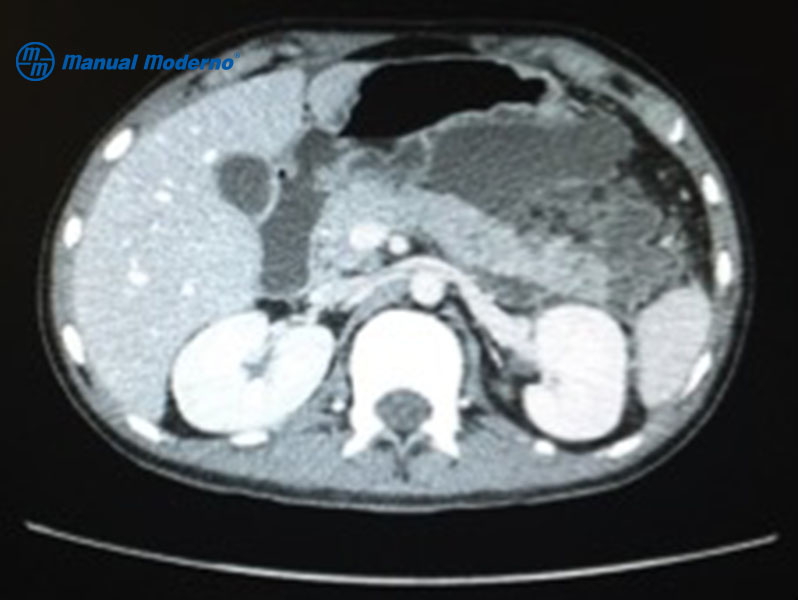
Figura 7.4.4A. Múltiples colecciones necróticas agudas visibles en la tomografía computarizada abdominal con contraste intravenoso.
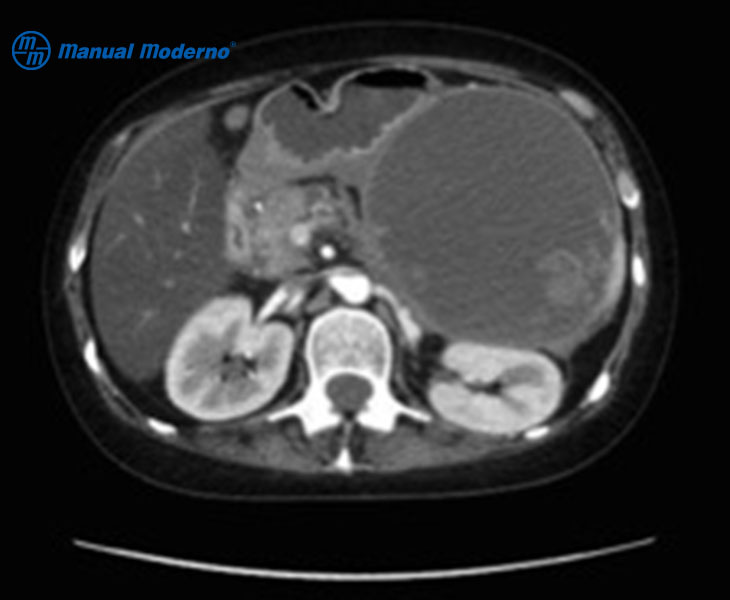
Figura 7.4.4B. Necrosis amurallada por tomografía computarizada abdominal con contraste intravenoso. Se observa una cavidad con contenido líquido y sólido.
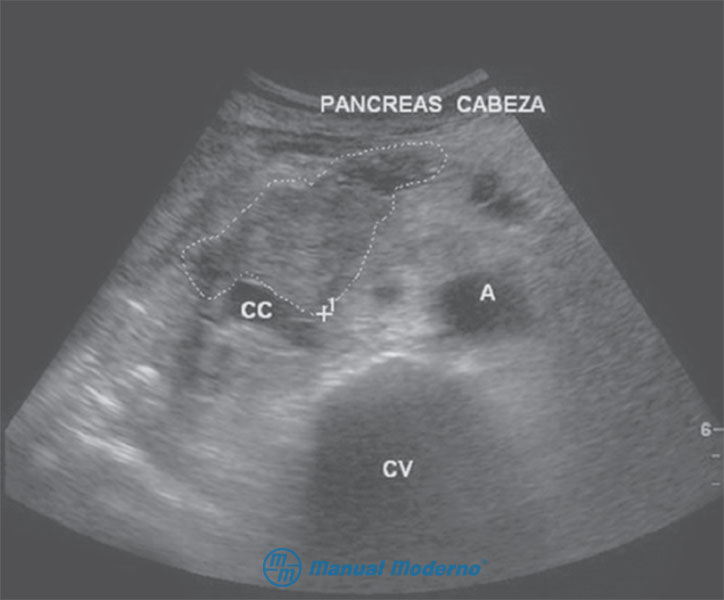
Figura 7.5.6A. Ultrasonido abdominal que muestra la cabeza pancreática aumentada de tamaño, una imagen hipoecoica de 2.8 cm irregular, y márgenes mal definidos, lo cual corresponde a un cáncer de páncreas (cortesía del Centro Universitario de Imagen Diagnóstica, Hospital Universitario, UANL).
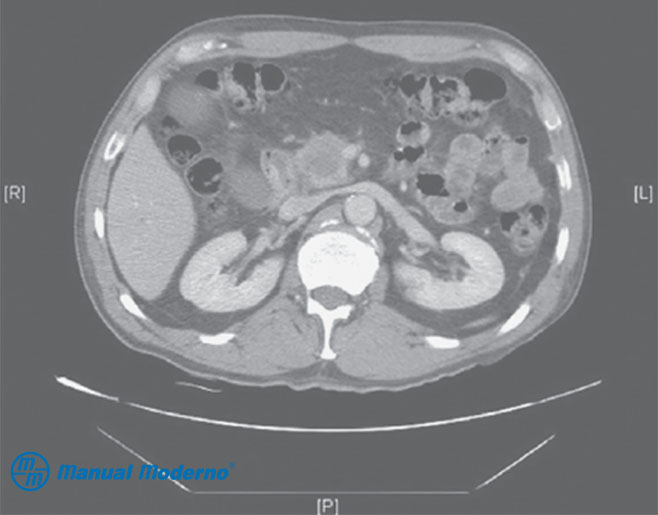
Figura 7.5.6B. TAC de abdomen con contraste intravenoso que muestra una tumoración en la cabeza del páncreas de 3 x 3 cm, hipodensa, redondeada, de bordes irregulares, con un halo periférico hiperdenso en la cabeza del páncreas. Además, se observa dilatación del conducto pancreático (cortesía del Centro Universitario de Imagen Diagnóstica, Hospital Universitario, UANL).
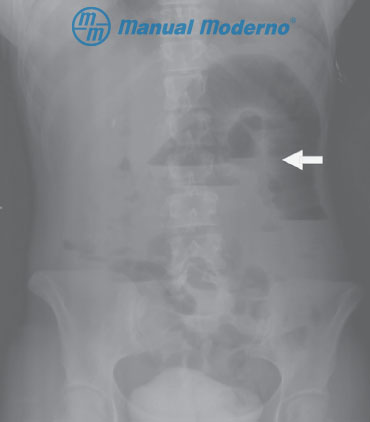
Figura 8.2.5A. Radiografía simple de abdomen de un paciente con obstrucción intestinal aguda del intestino delgado. Obsérvense las asas centrales, dilatadas con niveles hidroaéreos (fl echa). En las asas se reconocen válvulas conniventes, lo que le confiere el aspecto de pila de monedas y ausencia de dilatación de colon (cortesía del Centro Universitario de Imagen Diagnóstica, Hospital Universitario, UANL).
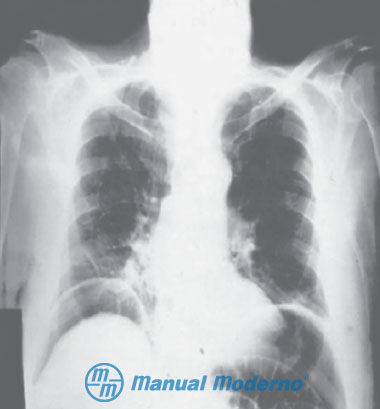
Figura 8.3.5A. Telerradiografía de tórax que muestra aire subdiafragmático en ambos lados debido a la perforación de víscera hueca (úlcera duodenal), lo que da lugar al “signo de la gaviota”.
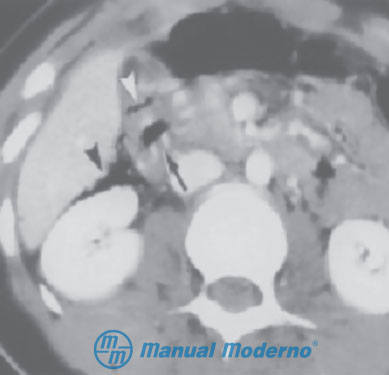
Figura 8.3.5B. TAC abdominal con medio de contraste que muestra aire libre en la cavidad peritoneal (flechas) debido a perforación de víscera hueca.